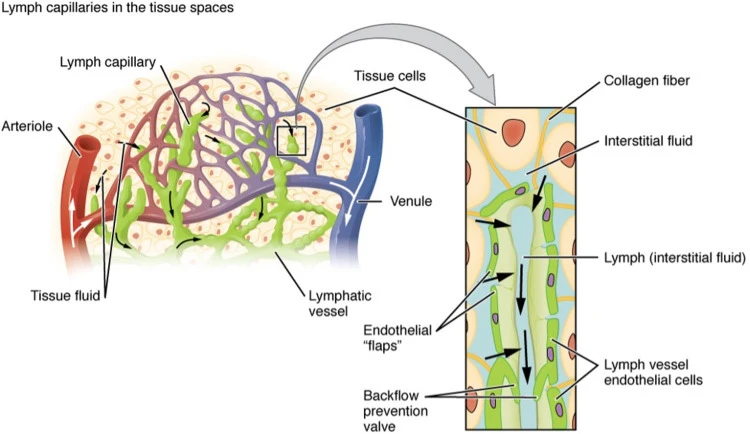
Nhuộm miễn dịch & phát hiện con đường của hệ bạch huyết ngoại biên trong não
Xuất bản: 14/01/2021
- Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
- Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
- Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
- Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
- Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Tác giả: Eva Mezey, Ildikó Szalayova, Christopher T. Hogden, Alexandra Brady, Ágnes Dósa, Péter Sotonyi, Miklós Palkovits
Nguồn tài liệu: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7826383/
Ý nghĩa
Nội dung chính [hiện]
Mối liên hệ giữa não và hệ bạch huyết ngoại vi đã được nghiên cứu trong 250 năm, chủ yếu ở động vật. Các dấu hiệu đặc biệt cho thấy tế bào nội mô bạch huyết (LEC) đã được phát hiện cách đây khoảng một thập kỷ. Chúng tôi nhuộm não người sau khi chết bằng LYVE1 và PDPN để xác định tế bào nội mô bạch huyết. Các tế bào dương tính với chất đánh giá được tìm thấy trong các màng bao phủ não, thành mạch, khoang quanh mạch máu và giữa các sợi thần kinh. Những khoảng trống này dường như cũng chứa các tế bào T và được kết nối với hệ bạch huyết ngoại vi thông qua các lối đi trong khoang mũi, dây thần kinh thị giác và nền sọ. Phát hiện của chúng tôi cho thấy con đường mà các chất thải của não đi theo rời khỏi hệ thần kinh trung ương, con đường có thể là hai chiều.
Bản tóm tắt
Gần 150 bài báo về bạch huyết não đã được xuất bản trong 150 năm qua. Gần đây, thông tin trong các bài báo này đã được tổng hợp thành một bức tranh về hệ bạch huyết của hệ thần kinh trung ương (CNS), nhưng cấu trúc tinh tế của các thành phần bạch huyết trong não người dựa trên các dấu hiệu đặc biệt, hình ảnh cụ thể của nội mô bạch huyết vẫn chưa được mô tả. Chúng tôi đã sử dụng kháng thể LYVE1 và PDPN để hình dung các tế bào dương tính với dấu hiệu bạch huyết (tế bào dương tính với dấu hiệu bạch huyết) trong các mẫu não người sau khi chết, màng não, xoang hang (cavum trigeminale) và các dây thần kinh sọ. Phát hiện của chúng tôi được củng cố bằng kháng thể VEGFR3. Tế bào dương tính với dấu hiệu bạch huyết hiện diện trong khoang quanh mạch máu, thành động mạch và tĩnh mạch nhỏ và lớn, lớp giữa của các mạch lớn dọc theo màng tế bào cơ trơn và lớp vỏ ngoài mạch máu. Nhuộm dấu hiệu bạch huyết được phát hiện ở màng mềm, màng nhện, xoang tĩnh mạch và giữa các lớp của màng cứng. Có nhiều tế bào dương tính với dấu hiệu bạch huyết ở quanh dây thần kinh và nội tiết của các dây thần kinh sọ. Chất thải hòa tan có thể di chuyển từ nhu mô não qua các đường quanh mạch máu và đường cận mạch đến khoang dưới nhện gần nhất, sau đó di chuyển dọc theo màng cứng hoặc các dây thần kinh sọ. Các chất thải dạng hạt di chuyển dọc theo các màng cứng về phía lỗ tĩnh mạch cảnh, “lá sàng của xương sàng” (là cấu trúc ngăn cản sự myelin hoá từ đường dẫn truyền thần kinh thị giác vào nhãn cầu) và quanh dây thần kinh của các dây thần kinh sọ để đi vào hệ bạch huyết cổ. Các tế bào T dương tính với CD3 dường như ở rất gần với tế bào dương tính với dấu hiệu bạch huyết trong các khoang quanh mạch máu/cạnh dây thần kinh khắp não. Cả phương pháp nhuộm miễn dịch và qPCR đều xác nhận sự xuất hiện của các phân tử bám dính trong hệ thần kinh trung ương được biết là có liên quan đến quá trình di chuyển tế bào T.
Lymph (được đặt theo tên nữ thần La Mã Lympha, nghĩa là nước sạch) được người Hy Lạp cổ phát hiện. Các tuyến bạch huyết, ngày nay được gọi là hạch bạch huyết, đã được đề cập trong tập hợp các tài liệu có niên đại từ 300 đến 500 năm trước Công nguyên. Hệ thống bạch huyết (bao gồm các mạch và hạch bạch huyết) được mô tả vào năm 1652 đến 1653 bởi cả người Thụy Điển (Olaus Rudbeck) và bác sĩ người Đan Mạch (Thomas Bartholin). Bằng chứng đầu tiên cho thấy bạch huyết xuất hiện trong não được công bố vào năm 1787 bởi Mascagni, một giảng viên giải phẫu ở Siena, Ý.
Năm 1869, Schwalbe đã chứng minh rằng chất đánh dấu được tiêm vào khoang dịch não tủy (CSF) sẽ tìm đường đến hệ bạch huyết ngoài sọ ở chó. Ông kết luận rằng khoang dưới nhện (SAS) trong não tương ứng với hệ bạch huyết ở ngoại vi. Mối liên hệ trực tiếp (nhưng không phải mạch bạch huyết) giữa khoang dưới nhện và mô quanh mạch máu mũi lần đầu tiên được chứng minh ở người bởi Key và Retzius- những người đã tiêm chất đánh dấu vào khoang khoang dịch não tủy trong quá trình khám nghiệm tử thi. Tuke cho rằng chất thải được di chuyển từ não người qua khoang quanh mạch máu (PVS). Kể từ đó, hơn 150 nghiên cứu đã được công bố về chủ đề này. Hầu như tất cả đều mô tả các nghiên cứu về loài gặm nhấm. Các nghiên cứu ban đầu dựa trên sinh vật học và những gì đã biết về hệ bạch huyết ngoại vi. Vào khoảng đầu thế kỷ 20, thành viên của hai nhóm cho rằng “ống dẫn bạch huyết” ở cột sống không phải là các mạch có thành mạch tốt mà là một không gian liên tục xung quanh các mao mạch. Zwillinger cho thấy ở người có mối liên hệ giữa khoang dưới nhện và mạng lưới bạch huyết ở niêm mạc mũi. Điều này được chấp nhận vào thời điểm đó . Mối liên hệ giữa khoang dưới nhện và vùng quanh dây thần kinh của dây thần kinh khứu giác và mạch bạch huyết mũi trong lá sàng của xương sàng đã được mô tả ở thỏ và được xác nhận ở nhiều loài gặm nhấm cũng như ở người.
Từ năm 1960 đến năm 1990, giai đoạn thứ hai khi nghiên cứu về hệ bạch huyết của hệ thần kinh trung ương bùng nổ. Có rất nhiều nghiên cứu bổ sung trên động vật đã được thực hiện mà không có sự hỗ trợ như chúng ta có ngày nay. Trong thời gian này, các cụm từ tiền mạch, quanh mạch và cận mạch đã được giới thiệu để mô tả hệ bạch huyết của hệ thần kinh trung ương. Nếu không có dấu hiệu bạch huyết, người ta vẫn đặt câu hỏi về sự tồn tại của hệ thống “bạch huyết” hệ thần kinh trung ương. Trong số những nghiên cứu quan trọng trong thời kỳ này, một số được thực hiện bởi một nhóm các nhà khoa học Hungary. Földi và các cộng sự đã mô tả con đường “tiền bạch huyết-bạch huyết” và nói rằng nó đi quanh mạch máu (tiền bạch huyết) cho đến khi nó đến lỗ tĩnh mạch cảnh nơi nó gặp các mạch bạch huyết riêng biệt xung quanh động mạch cảnh trong và sau đó kết thúc ở các hạch bạch huyết sâu ở cổ. Họ mô tả sự xuất hiện của các mạch bạch huyết trong sọ ở lỗ tĩnh mạch cảnh trong các lớp của màng cứng. Csanda và cộng sự phát hiện ra rằng sau tổn thương não do cấy ytri 90 vào não chó, thỏ, mèo và chuột, hầu hết các chất phân hủy của mô não đặc biệt có nguồn gốc từ vỏ myelin… đều bị thực bào bởi các tế bào vi mô và vận chuyển đến thành mạch. Ở các mạch máu xa, các hạt lipid…Trong lớp ngoại vi, có những phần mở rộng giống như bán trăng, cũng được quan sát sau khi chặn dịch bạch huyết cổ…. Sự di chuyển của các chất này có xu hướng hướng tới bề mặt vỏ não… Những đánh giá chi tiết về nghiên cứu về bạch huyết từ thời xa xưa nhất cho đến giữa thế kỷ 20 được viết bởi Cserr, Földi, Koh và các cộng sự của họ. Gần đây, một số công nhân đã xác nhận những phát hiện trước đó và bổ sung thêm các chi tiết mới bằng kỹ thuật hiện đại.
Cuối cùng, giai đoạn thứ ba, giai đoạn nghiên cứu mới về bạch huyết não đã bắt đầu. Các nhà điều tra trong lĩnh vực này đã nỗ lực chứng minh sự tồn tại của hệ bạch huyết hoạt động chức năng trong hệ thần kinh trung ương bằng cách sử dụng các dấu hiệu nội mô bạch huyết cụ thể. Sự phát triển mới nhất gần đây là việc phát hiện ra “hệ bạch huyết”, một hệ thống đào thải chất thải bao gồm các ống quanh mạch máu được tạo bởi các quá trình tế bào hình sao tham gia hình thành màng ngăn máu não (BBB). CSF di chuyển qua hệ thống này trong khoang quanh mạch máu của động mạch tới khoang quanh mạch máu của tĩnh mạch và di chuyển các chất thải vào khoang dưới nhện và xoang tĩnh mạch. Johnston và các cộng sự đã mô tả vai trò của xoang hang (và các xoang tĩnh mạch khác) trong việc hấp thu dịch não tủy. Trong một đánh giá mở rộng gồm có các hình ảnh nguyên bản sử dụng MRI cấu trúc, Ramirez và các cộng sự đã mô tả sự di chuyển của chất thải và ý nghĩa lâm sàng có thể có của bất kỳ sự xáo trộn nào trong các sự di chuyển này.
Vào năm 2015, hai nhóm độc lập đã báo cáo sự tồn tại của các mạch bạch huyết trong màng cứng của chuột bằng cách sử dụng các dấu hiệu nội mô bạch huyết cụ thể. Louveau và cộng sự tuyên bố rằng “những cấu trúc này thể hiện tất cả các đặc điểm phân tử của tế bào nội mô bạch huyết, có thể vận chuyển cả chất lỏng và tế bào miễn dịch từ dịch não tủy và được kết nối với các hạch bạch huyết sâu ở cổ tử cung.” Vào năm 2017, nhóm của Reich đã sử dụng phương pháp chụp ảnh gadolinium (thuốc tương phản trong cộng hưởng từ) MRI không xâm lấn và sau khi tiêm tĩnh mạch chất tương phản để nhìn thấy các mạch bạch huyết ở màng não linh trưởng của con người và động vật không phải con người. Ringstad và Eide đã sử dụng MRI kết hợp với chất đánh dấu CSF và theo dõi theo thời gian. Họ nhìn thấy chất đánh dấu đi vào màng cứng gần lối vào của các tĩnh mạch vỏ não. Kết luận rằng có sự đi qua của các phân tử qua màng nhện và màng cứng đóng vai trò là cầu nối giữa não và hệ bạch huyết ngoại biên. Meng và cộng sự đã sử dụng sự gián đoạn BBB phá vỡ bằng chụp cộng hưởng từ để chứng minh sự phân bố các chất tương phản trong khoang quanh mạch máu, khoang dưới nhện và không gian xung quanh các tĩnh mạch lớn chảy về xoang màng cứng ở người. Những nghiên hữu ích này sử dụng các chỉ số bạch huyết cụ thể nhưng hạn chế tầm quan trong của dữ liệu của con người.
Chúng tôi đã xem xét trong não người sau khi chết (có và không có bệnh thần kinh) để tìm sự hiện hữu của các dấu hiệu nội mô bạch huyết (PDPN và LYVE1) để tìm hiểu các con đường mà các chất thải có thể đi từ không gian kẽ của não đến ngoại vi. Chúng tôi đã phân tích mối quan hệ giữa các tế bào nội mô dương tính với dấu hiệu bạch huyết và mạch máu của nhu mô não và màng não. Đồng thời khám phá sự hiện diện của tế bào bạch huyết trong những không gian này. Mục tiêu của chúng tôi không phải là so sánh bộ não bị bệnh với bộ não của những đối tượng không mắc bệnh thần kinh hoặc để phân biệt giữa các bệnh thần kinh khác nhau về sự khác biệt về sự hiện diện, vị trí hoặc số lượng các thành phần bạch huyết. Thật vậy, chúng tôi không thấy bất kỳ sự khác biệt nào giữa các đối tượng mắc hoặc không mắc bệnh thần kinh trong việc phân bổ các dấu hiệu mà chúng tôi sử dụng. Những gì chúng tôi mô tả trong bài báo là những phát hiện có vẻ giống nhau ở tất cả các bộ não được nghiên cứu, nhất quán và không khác biệt ở 12 vùng của 10 bộ não mà chúng tôi đã phân tích. Điều này đúng với sự hiện diện và phân bố của tế bào T dương tính với CD3 mà chúng tôi thấy trong các khoang bạch huyết. Trong nhu mô não cũng như trong khoang màng não, chúng tôi nhận thấy các tế bào T ở rất gần với các tế bào được đánh dấu bằng dấu hiệu bạch huyết ở cả não bình thường và não bị bệnh.
Chúng tôi đã sử dụng phương pháp hóa mô miễn dịch đa thành phần bằng cách sử dụng khuếch đại tín hiệu của tyramide (một loại amin tự nhiên) (TSA) để định vị các dấu hiệu mà chúng tôi đã sử dụng và cũng thực hiện PCR để xác nhận sự tồn tại của mRNA mã hóa chúng trong một trong những mẫu tương tự mà chúng tôi đã sử dụng cho hóa mô miễn dịch (ICC). Do tính chất của nghiên cứu, chúng tôi không thể xem xét chuyển động của chất lỏng trong không gian mà chúng tôi mô tả nhưng cảm thấy rằng việc bổ sung các chi tiết hình thái trong não người khỏe mạnh và não bệnh lý sẽ bổ sung thêm thông tin có giá trị cho những gì hầu hết đã được biết đến ở não không phải con người.
Kết quả
Vị trí hóa mô miễn dịch của bạch huyết trong não người.Chúng tôi đã sử dụng kháng thể LYVE1 và PDPN để hình dung các tế bào nội mô bạch huyết. Chúng tôi không thể xác định được kháng thể Prox1 có thể đảm bảo, cho phép chúng tôi tìm được dấu hiệu hạch bạch huyết trong các mẫu sau khi chết một cách đáng tin cậy. Chúng tôi cũng đã cố gắng sử dụng kháng thể kháng VEGFR3, một biểu hiện đặc biệt của nội mô bạch huyết (so với mạch máu), để xem liệu các thụ thể có tập trung vào các yếu tố dương tính với LYVE1 hoặc PDPN hay không nhưng VEGFR3 được phân bố rộng rãi trong nhu mô não và dường như không phải là lựa chọn thích hợp cho mục đích này.
Ban đầu, chúng tôi đánh dấu các phần bằng kháng thể yếu tố LYVE1 và von Willebrand. Loại thứ hai được sử dụng như một chất đánh dấu nội mô mạch máu (cũng đánh dấu dạng hòa tan của yếu tố von Willebrand trong lòng mạch máu bị tắc) và chúng tôi muốn phân biệt mạch máu với nội mô bạch huyết (Hình 1). Sự co rút của các mô sau khi chết được cố định bằng Formaldehyde, gây ra các khoảng trống nhân tạo xung quanh các mạch máu và việc đánh dấu bạch huyết thường được nhìn thấy ở một bên chứ không phải cả hai bên của các khoảng trống tạo thành.
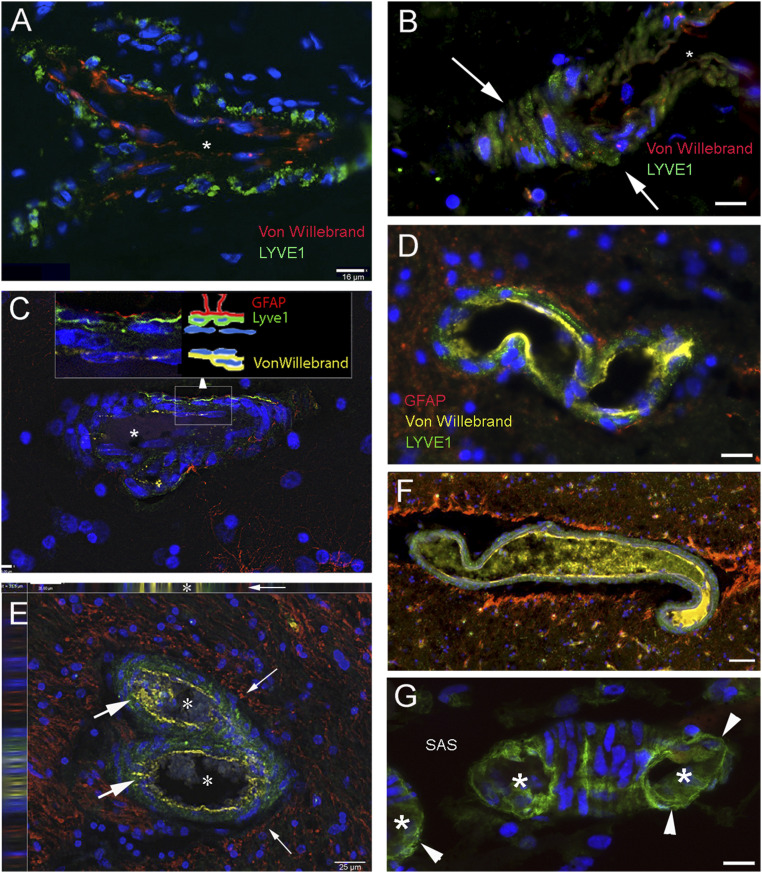
Hình 1: Các tế bào bạch huyết được gắn nhãn LYVE1 dọc theo hoặc bên trong thành mạch ở vỏ não trán và vỏ não của con người. Các phần từ vùng não của bệnh nhân mắc các bệnh về thần kinh ( A và C–F ) hoặc chết vì những căn bệnh lẽ ra không ảnh hưởng đến hệ thần kinh trung ương ( B và G ) đã được đánh dấu màu miễn dịch bằng cách sử dụng phương pháp hóa mô miễn dịch huỳnh quang nhiều kênh với khuếch đại tín hiệu tyramide (TSA). LYVE1, một glycoprotein màng đặc hiệu cho các tế bào nội mô bạch huyết, được đánh dấu màu xanh lá cây trong tất cả các bảng. Nội mô mạch máu được thể hiện bằng màu đỏ ở A và B và màu vàng ở tất cả các bảng khác, thể hiện sự biểu hiện của yếu tố von Willebrand. tế bào thần kinh đệm hình sao được nhuộm màu đỏ hình thành các giới hạn glia xung quanh các mạch trong C – F. A – C cho thấy các cấu trúc có kích thước mao mạch nhỏ được nhuộm màu cho yếu tố LYVE1 và von Willebrand. DAPI, một vết nhiễm sắc thể có màu xanh lam, xác định chính xác nhân tế bào trong tất cả các hình ảnh. Mũi tên trắng ở B chỉ vào các tế bào dương tính với LYVE1 ở bên ngoài mạch trước khi nó được cắt ngang và có thể nhìn thấy được lòng mạch. Trong C , hình ảnh là một lát cắt của chuỗi Z được chụp ở các khoảng cách 0,5 μm. Hình nhỏ trong sơ đồ bên cạnh khu vực (hình vuông) được mở rộng hiển thị các lớp được nhuộm bằng các điểm đánh dấu khác nhau. ( D ) Ba lớp tế bào (nội mô mao mạch, bạch huyết và tế bào thần kinh đệm) được nhuộm ba màu khác nhau. E mô tả một mạch phân nhánh (lumina được dán nhãn dấu hoa thị), với nhãn LYVE1 trên tường (mũi tên lớn) và các tế bào bạch huyết giữa màng đáy trong các lớp cơ. Hình ảnh này là một phần của ngăn chữ Z và các tấm bên ở Trên cùng và Bên trái hiển thị các mặt nhìn xác nhận vết nhuộm dương tính với bạch huyết (màu xanh lá cây) lót bên trong nội mô mạch máu dương tính với yếu tố von Willebrand (màu vàng) ở một bên và một khoảng trống quanh mạch máu được lót bằng nhuộm tế bào thần kinh đệm hình sao màu đỏ (mũi tên nhỏ). F tương tự như D ngoại trừ khoảng trống nhân tạo lớn xung quanh tàu. Chất nhuộm miễn dịch màu vàng trong lòng đại diện cho yếu tố von Willebrand hòa tan; (G) một mảnh mao mạch nhỏ trên bề mặt vỏ não có tế bào nhuộm LYVE1 (đầu mũi tên). Cả ở mặt cắt ngang (được đánh dấu bằng dấu hoa thị) và mặt cắt dọc, các tế bào bạch huyết tạo thành bức tường bên ngoài. Ngôi sao trong A – C đánh dấu độ sáng của mạch máu. khoang dưới nhện, không gian dưới nhện. (Thanh tỷ lệ: A , B, D , G , 16 m; C , 7 m; E , 25 m; F , 50 m.)
Chúng tôi liên tục tìm thấy các tế bào dương tính với LYVE1 xếp các khoang quanh mạch máu xung quanh động mạch và tĩnh mạch trong các mẫu não người ở vỏ não và dưới vỏ não (Hình 1) Trong hình 1A, mạch phân nhánh được bao quanh rõ ràng bởi các tế bào được đánh dấu kháng thể kháng LYVE1. Hình 1B cho thấy thành ngoài của một tiểu động mạch nhỏ cắt ngang. Các tế bào màu xanh lá cây có nhãn LYVE1 được nhìn thấy rõ ràng bên ngoài thành mạch. Khi tế bào hình sao cũng được nhuộm miễn dịch bằng tế bào thần kinh đệm hình sao, các quá trình của chúng dường như có sự tiếp xúc chặt chẽ với tế bào dương tính với dấu hiệu bạch huyết (Hình 1 C-F). Trong khoang dưới nhện, nhuộm LYVE1 thấy rõ trên thành của các mạch nhỏ (Hình 1G). tế bào dương tính với dấu hiệu bạch huyết hiện diện ở lớp giữa (lớp trung gian) giữa các tế bào cơ trơn trong các động mạch nhỏ hoặc các sợi collagen và đàn hồi trong tĩnh mạch.
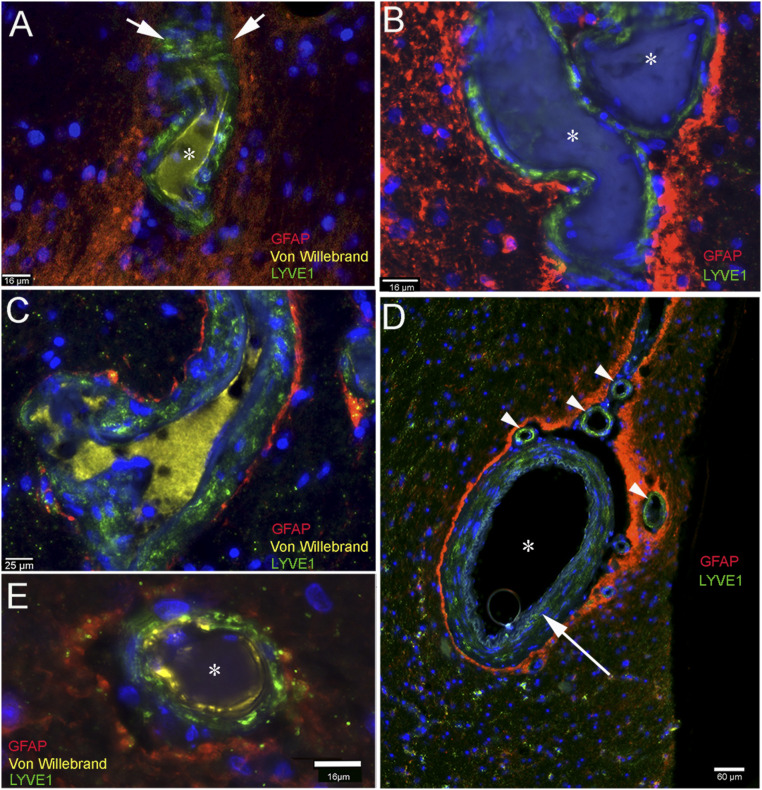
Trong tất cả các vùng não được kiểm tra (vỏ não, hồi hải mã, thể vân), tế bào thần kinh đệm hình sao (tế bào thần kinh đệm hình sao) mô tả các giới hạn glia và đánh dấu LYVE1 có thể nhìn thấy được trong lớp ngoại vi của mạch máu (Hình 2). Hình 2D cho thấy một động mạch lớn có nhãn LYVE1 ở phần ngoài của nó và một số động mạch nhỏ dương tính với LYVE1 (vasa vasorum) cung cấp máu cho mạch lớn. Nhuộm tế bào thần kinh đệm hình sao phác thảo các giới hạn glia được hình thành bởi các chân tế bào hình sao giáp với khoang quanh mạch máu.
Hình 2. Các tế bào dương tính với LYVE1 trong mạch máu ở một số vùng não; các giới hạn glia được dán nhãn bằng nhuộm tế bào thần kinh đệm hình sao phác thảo phía nhu mô của khoang quanh mạch máu. Các phần được đánh dấu miễn dịch đa thành phần từ nhiều vùng não khác nhau của bệnh nhân. Quá trình phát huỳnh quang màu đỏ của tế bào hình sao (glia limitans) bao quanh một không gian nhân tạo nhỏ xung quanh các mạch máu. LYVE1 được nhuộm màu xanh lá cây và hiển thị các tế bào dương tính với dấu hiệu bạch huyết có trong mạch máu trong tất cả các bảng. A và B cho thấy yếu tố von Willebrand nhuộm trong tế bào nội mô mạch máu và cả dạng hòa tan của nó trong lòng mạch máu ( A và C ). Các tế bào dương tính với LYVE1 màu xanh lá cây được phân tán giữa các tế bào cơ của thành mạch. Hình C cho thấy một phần mạch máu tĩnh mạch, đánh dấu rõ ràng các tế bào trên thành bằng màu xanh lá cây (LYVE1) và giới hạn thần kinh đệm (tế bào thần kinh đệm hình sao) màu đỏ. Ở hình D , có thể nhìn thấy một động mạch lớn (dấu hoa thị) với các tế bào dương tính được đánh dấu LYVE1 trong lớp cơ ở lớp cơ (mũi tên dài) giữa các màng đáy. Màu đỏ đại diện cho các giới hạn glia bao quanh động mạch và cả các mạch máu nhỏ nhuộm LYVE1 (vasa vasorum) trong phiêu lưu. E , Tương tự như A – C , nhưng quan sát khoảng trống nhân tạo lớn xung quanh tàu. (Thanh tỷ lệ: A , B và E , 16 μm; C , 25 μm; D , 60 μm.)
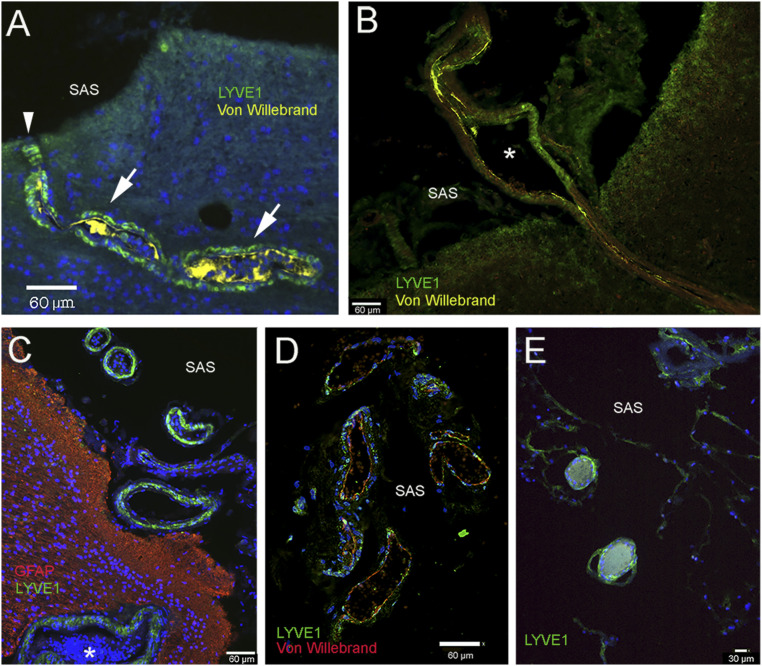
Chúng tôi đặc biệt chú ý đến các mạch máu đi vào và ra khỏi khoang dưới nhện (Hình 3). Khi chúng tôi kiểm tra các mạch đơn lẻ trên bề mặt vỏ não theo từng phần nối tiếp, chúng tôi tìm thấy một số kênh nhỏ dương tính với LYVE1 thiếu các dấu hiệu nội mô mạch máu (Hình 3E). Chúng tôi cũng phát hiện ra rằng các động mạch xuyên qua vỏ não có liên quan đến các tế bào dương tính với LYVE1 dọc theo đường đi của chúng (Hình 3). Tất cả các mạch trong khoang dưới nhện đều có tế bào nhuộm màu dương tính với LYVE1 trong lớp vỏ của chúng (Hình 3 C-E).
Hình 3: Các dấu hiệu bạch huyết ở thành mạch kết nối với khoang dưới nhện (khoang dưới nhện) trên vỏ não trán và vỏ não đỉnh. A – C và E lấy từ bệnh nhân có bệnh lý thần kinh tiềm ẩn, còn C lấy từ bệnh nhân không mắc bệnh thần kinh. A và B cho thấy các mạch máu ở vỏ não trán kết nối với khoang dưới nhện (khoang dưới nhện) trong bè màng nhện. Mặt ngoài của mạch máu được mô tả bởi các tế bào màu xanh lá cây dương tính với LYVE1, trong khi nội mô mạch máu có màu vàng (nhuộm yếu tố von Willebrand). Trong A , các tế bào dương tính với LYVE1 màu xanh lá cây theo sau mạch được dán nhãn bằng mũi tên. Điểm vào của tàu ở biên giới khoang dưới nhện được dán nhãn bằng đầu mũi tên. C – E thể hiện các tàu trong khoang dưới nhện. Ở C , thành ngoài của mạch máu dương tính với LYVE1 (màu xanh lá cây) và các tế bào hình sao (GFAP) ở bề mặt não có màu đỏ. Dấu hoa thị trong nhãn B và C là lòng mạch máu. (Thanh tỷ lệ: A – D , 60 μm; E , 30 μm.)
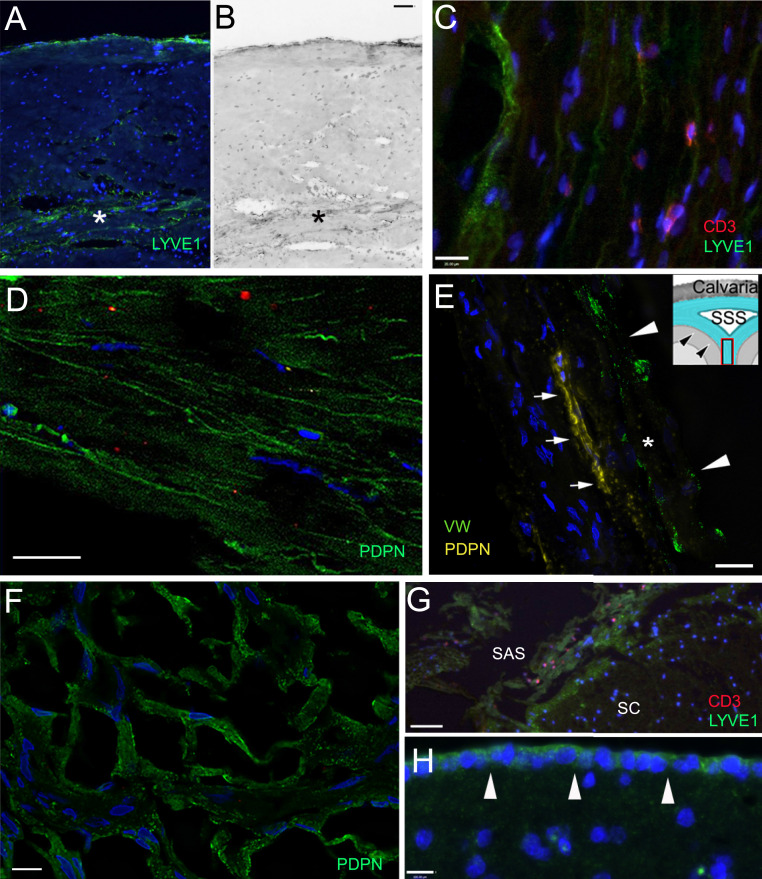
Phần màng cứng nguyên bào sợi/ gian bào collagen của màng cứng chứa các thành phần bạch huyết nằm rải rác trên thành của các mạch xuyên thủng. Ngược lại, ở phần bên trong mềm hơn hơn (còn gọi là màng não) của màng cứng, các kênh nhỏ—các khoảng giữa các lớp—được vạch ra bởi các tế bào dương tính với dấu hiệu bạch huyết (Hình 4), được miễn dịch bởi cả LYVE1 (Hình 4 A-C) và PDPN (Hình 4 D và E). Một trong những kênh bạch huyết này được đánh dấu để tìm podoplanin ở vùng não liềm của màng cứng ở Hình 4E (mũi tên nhỏ) ở gần một mạch máu (đầu mũi tên) được đánh dấu bằng biểu hiện yếu tố von Willebrand trong huỳnh quang màu xanh lá cây. Có rất nhiều LYVE1 (Hình 4F) và PDPN (Hình 4 G) các tế bào dương tính liên kết với các tế bào của màng nhện (còn gọi là hàng rào màng nhện) và các tế bào T dương tính với CD3 đôi khi có thể được tìm thấy trong số chúng (Hình 4G). Dọc theo toàn bộ bề mặt não, các tế bào của màng mềm cũng dương tính với LYVE1 (Hình 4G và H). Chúng tôi cho rằng các tế bào dương tính với dấu hiệu bạch huyết xung quanh mạch máu có nguồn gốc từ vật liệu màng mềm khi nó đi theo bề mặt não và được “nhặt” bởi các mạch máu phá vỡ bề mặt để di chuyển về phía nhu mô sâu hơn.
Hình 4: Đánh dấu bạch huyết (LYVE1 và PDPN) trong màng não. Các phần màng não của những người chết vì nguyên nhân không liên quan đến thần kinh ( A , B , và E – G ) và những người mắc bệnh thần kinh ( C và D ). ( A – D ) Các đoạn màng não trên (màng xương) và màng não dưới của màng cứng tính từ xoang dọc; ( E ) liềm não; ( F và G ) màng nhện; ( H ) là vấn đề. ( A và B ) Ảnh vùng sáng của cùng một trường; trong màng cứng các kênh bạch huyết dương tính với LYVE1 được nhuộm màu xanh lá cây. Lớp màng xương bên trong của màng cứng dính vào màng xương của hộp sọ. Lớp này bao gồm các sợi collagen rắn chắc. Lớp màng não (được đánh dấu bằng ngôi sao) đối diện với màng nhện. Lớp này kém đặc hơn; mạch máu và các thành phần bạch huyết lấp đầy các khoảng gian màng. Các mao mạch và tiểu tĩnh mạch sau mao mạch bị thủng (không có BBB). ( C ) Có thể nhìn thấy các tế bào bạch huyết dương tính với LYVE1 và các tế bào T rải rác (nhuộm màu đỏ bằng kháng thể CD3) trong các màng collagen của màng cứng. D cho thấy podoplanin (PDPN; một dấu hiệu được chấp nhận khác của tế bào nội mô bạch huyết) dương tính (màu xanh lá cây) trong màng cứng ở bề mặt bên trong của nền sọ, trong xoang hang. E thể hiện kênh bạch huyết dương tính với PDPN (huỳnh quang màu vàng) (mũi tên nhỏ) bên cạnh một đoạn mạch được dán nhãn dấu hoa thị và đầu mũi tên (nội mô mạch máu dương tính với yếu tố von Willebrand; huỳnh quang màu xanh lá cây) trong một phần mỏng (lấy từ ngăn xếp Z ở độ dày quang học 1-µm) của falx cerebri (giải phẫu được thể hiện trong Hình nhỏ, trong đó các đầu mũi tên chỉ vào màng cứng và hình vuông hiển thị diện tích gần đúng của falx cerebri nơi lấy mẫu. F thể hiện nhuộm podoplanin của màng nhện (từ tiếng Hy Lạp có nghĩa là nhện). Nó giống như một mạng nhện. Ở G , nhiều tế bào biểu mô dương tính với LYVE1 có thể được quan sát thấy trong màng nhện bao phủ tủy sống (SC) và thỉnh thoảng có các tế bào T dương tính với CD3 phát huỳnh quang màu đỏ gần các tế bào mô liên kết dương tính với LYVE1. ( H ) Các tế bào của màng mềm (được chỉ bằng mũi tên trắng) trên bề mặt vỏ não trước biểu hiện LYVE1 (màu xanh lá cây). khoang dưới nhện, khoang dưới nhện; SSS, xoang dọc trên. (Thanh tỷ lệ: A và B , 100 µm; C–F , như được dán nhãn.)
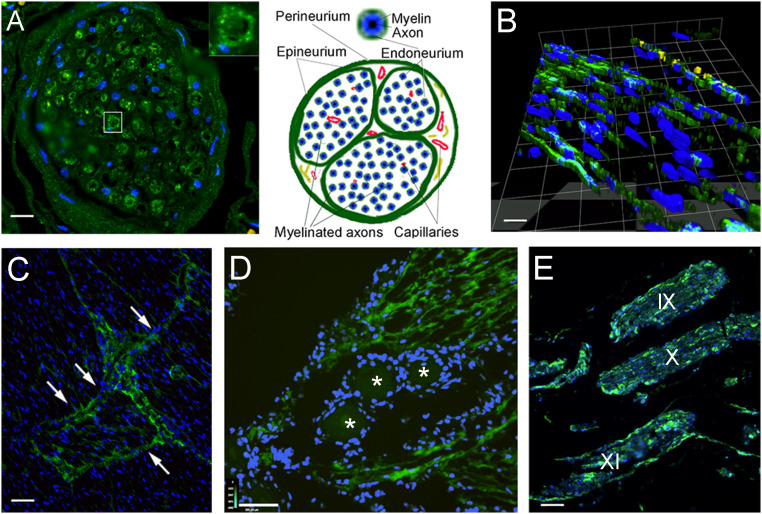
Các dây thần kinh sọ cũng chứa tế bào dương tính với dấu hiệu bạch huyết. Chúng tôi tìm thấy các tế bào dương tính trong các nhánh của dây thần kinh ba nhánh (Hình A-D), bên trong và ở xung quanh hạch ba nhánh, các phần xoang hang ba nhánh(Phương pháp) (Hình 5D). Điều này cũng rõ ràng ở các mặt cắt dọc của cơ ba nhánh (Hình 5D) và các dây thần kinh sọ não khác bao gồm dây thần kinh thiệt hầu, dây thần kinh phế vị và dây thần kinh phụ (Hình 5E, IX, X và XI). Sự giải mã ba chiều của chuỗi Z của một đoạn dây thần kinh ba nhánh cho thấy nhãn huỳnh quang của nội tiết trong Hình 5E. Các bó dây thần kinh được bao bọc bởi mô liên kết, được gọi là “đáy chậu”. Các tấm mô tương tự sẽ chia các bó dây thần kinh lớn thành các bó. Những vỏ bọc này được gọi là “bao ngoài bó thần kinh”. Trong một bó, các sợi trục được myelin hóa, và các sợi trục có myelin đơn lẻ được bao quanh bởi một lớp vỏ gọi là “mô kẽ thần kinh”. Trong mặt cắt ngang của dây thần kinh ba nhánh, nhiều sợi trục được myelin bao quanh bởi các tế bào nhuộm LYVE1 tạo thành nội tiết (Hinh 5)
Hình 5 Các dấu hiệu nội mô bạch huyết giữa các sợi thần kinh và các bó của dây thần kinh sọ. Các phần được nhuộm bằng kháng thể LYVE1 (hiển thị bằng huỳnh quang màu xanh lá cây) của dây thần kinh sọ và hạch ba nhánh của những người đã chết mà không biết rõ rối loạn thần kinh. ( A ) Mặt cắt ngang của một nhánh của dây thần kinh ba nhánh được hiển thị. Điều thú vị là, nội mô (các tấm mô liên kết xung quanh các sợi có myelin riêng lẻ) bị nhuộm màu tích cực; Hình nhỏ cho thấy sự mở rộng của một sợi thần kinh duy nhất được bao bọc bởi nội tiết dương tính với LYVE1. Nhân của các tế bào thần kinh đệm (tế bào Schwann và có thể cả microglia) và mô liên kết có màu xanh lam (DAPI). Trong hình B , hình ảnh tái tạo ba chiều của một phần dây thần kinh ba nhánh được hiển thị, chứng minh sự hiện diện của các tế bào dương tính với dấu hiệu bạch huyết dọc trong số các sợi thần kinh. Ở phía trên của hình ảnh, các tế bào có huỳnh quang màu vàng biểu thị yếu tố von Willebrand, biểu thị các tế bào nội mô mạch máu của một mạch nhỏ trong mặt cắt. (C ) Trên mặt cắt ngang của một bó dây thần kinh lớn, sự ghi nhãn rất rõ ràng giữa các bó (mũi tên). (D) Một mặt cắt qua hạch ba nhánh được hiển thị. Mặt cắt ngang của các sợi ba nhánh xung quanh các tế bào hạch (được đánh dấu bằng các ngôi sao) cho thấy dấu hiệu LYVE1 rõ ràng. ( E ) Phần thân não có nguồn gốc của các dây thần kinh sọ não IX, X và XI chạy song song. Perineurium cũng như các tế bào trong số các sợi trục có bao myelin trong sợi thần kinh được dán nhãn rõ ràng bằng LYVE1. (Thanh tỷ lệ: A , 50 μm; B , 25 μm; C và E , 110 μm; D , 130 μm.)
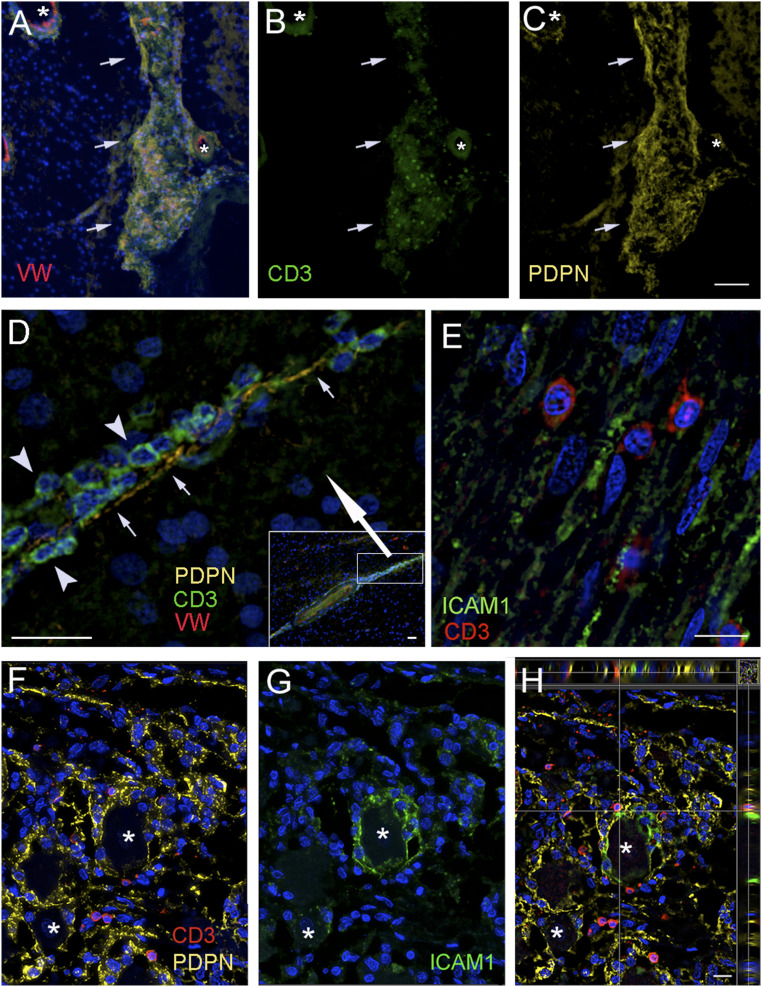
Sự hiện diện của tế bào lympho T trong không gian được phân định bởi tế bào dương tính với dấu hiệu bạch huyết. Chúng tôi đặt hỏi liệu các tế bào lympho có hiện diện trong các không gian được mô tả bởi tế bào dương tính với dấu hiệu bạch huyết hay không. Để trả lời câu hỏi này, chúng tôi nhuộm các phần của não và hạch ba nhánh bằng kháng thể kháng CD3, một dấu hiệu tế bào lympho T cụ thể. Trong tất cả các bộ não mà chúng tôi nghiên cứu, chúng tôi tìm thấy các tế bào lympho ngoại mạch ở các vùng não mà chúng tôi đã kiểm tra. Hình 6 cho thấy các mạch máu và hạch ba nhánh có tế bào dương tính với CD3. Hình 6A cho thấy một mạch lớn trong hạch hạnh nhân có nhiều tế bào dương tính với CD3 giữa thành ngoài của mạch và các tế bào dương tính với LYVE1 lót trong khoang quanh mạch máu. Tương tự, nhiều tế bào lympho T dương tính với CD3 có thể nhìn thấy xung quanh các mạch máu (trong khoang quanh mạch máu) ở rãnh đồi thị (Hình 6B), thể vân (Hình 6C và H), bên trong và xung quanh xoang hang và cavum trigeminale (hình 6 E và F) và trên bề mặt vỏ não đỉnh (Hình 6D). Hình 6G cho thấy mặt cắt ngang của một động mạch nhỏ trong hạch hạnh nhân, nơi có thể nhìn thấy rõ các tế bào T dương tính với CD3 trong khoang quanh mạch máu gắn với các tế bào dương tính với LYVE1 trên bề mặt mạch máu và ở phía bên kia của khe nhân tạo. Hình 6H cho thấy một vòng mạch máu ở thể vân, nơi có nhiều tế bào T được gắn vào bề mặt bên ngoài dương tính với LYVE1. Tương tự, hình 7A hiển thị một lớp phủ các tế bào T dương tính với CD3 (Hình 7B) gắn vào bề mặt dương tính với PDPN của một mạch lớn trong nhu mô (Hình 7C). Một quá trình được hình thành từ một chuỗi các tế bào dương tính với PDPN có thể được nhìn thấy trong hình 7D. Nhiều tế bào T dương tính với CD3 màu xanh lá cây (đầu mũi tên) được gắn vào màng (mũi tên) của tế bào dương tính với dấu hiệu bạch huyết. Chúng tôi đã tìm kiếm sự hiện diện của ICAM1, một phân tử bám dính được cho là có vai trò trong việc di chuyển tế bào T, trong dây thần kinh ba nhánh (Hình 7E) và nhận thấy tế bào T dương tính với CD3 nằm liền kề với các tế bào biểu hiện phân tử bám dính này. Trong chính hạch, chúng tôi thấy rằng màng của các tế bào vệ tinh xung quanh một số tế bào hạch dương tính mạnh với PDPN và nhiều tế bào T dương tính với CD3 nằm gần với màng tế bào dương tính với PDPN (Hình 7F). Chúng tôi đã thực hiện nhuộm ba lần để tìm kiếm các phân tử bám dính có thể liên quan đến khả năng di chuyển của tế bào T trong mô thần kinh. Trong hạch ba nhánh, các tế bào vệ tinh tạo thành một vòng bao quanh các tế bào hạch lớn đều nhuộm màu dương tính với PDPN (Hình 7F và H) và tiếp xúc gần gũi với tế bào T dương tính với CD3. Nhuộm ICAM1 được tìm thấy xung quanh một số tế bào hạch, nhưng trong những trường hợp này, kháng thể nhuộm màu tất cả các tế bào vệ tinh xung quanh tế bào thần kinh (Hình 7G và H) và được tập trung hóa với PDPN (Hình 7H).
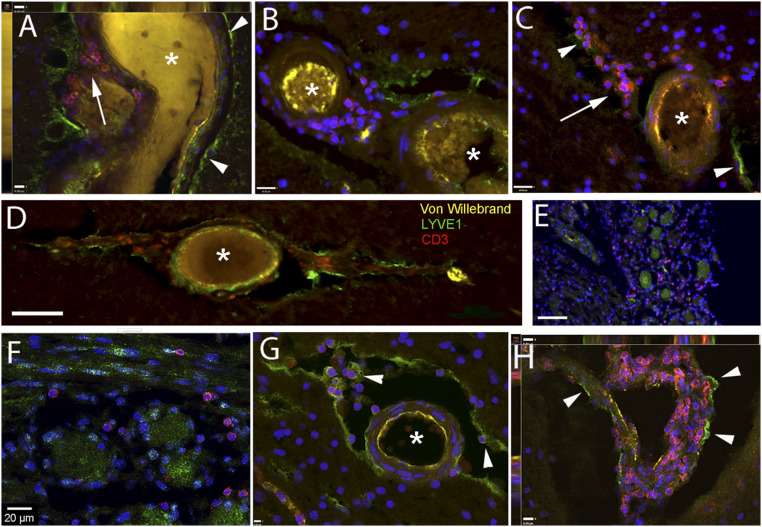
Hình 6 Các tế bào lympho T được xác định liền kề với nhuộm dương tính với LYVE1 trong khoang quanh mạch máu. Phần của những người mắc bệnh thần kinh ( A – D ) và không mắc bệnh thần kinh ( E – G ). Các mẫu được lấy từ hạch hạnh nhân ( A và G ), vỏ não đỉnh ( D ), hạch ba nhánh ( E và F ), thể vân ( C và H ) và các mạch máu ở rãnh đồi thị ( B ). Trong tất cả các hình ảnh, dấu hoa thị gắn nhãn lòng mạch máu, mũi tên chỉ vào tập hợp tế bào T và đầu mũi tên chỉ vào một số màng tế bào dương tính với LYVE1. A cho thấy mặt cắt ngang/dọc của một tĩnh mạch lớn, trong đó nội mô mạch máu có màu vàng (VW: von Willebrand), bề mặt não được lót bởi các tế bào màu xanh lá cây dương tính với LYVE1 và khoảng trống giữa bên ngoài thành mạch và LYVE1 Bề mặt dương tính được lấp đầy bởi một số lượng lớn tế bào T màu đỏ, dương tính với CD3. Hình ảnh là một cấp của ngăn xếp Z hiển thị các chế độ xem bên trên Top và Left . B cho thấy những hình ảnh tương tự với các động mạch nhỏ ở rãnh đồi thị ( B ) và ở thể vân ( C và H ). Một lần nữa, các tế bào T lại ở gần các cấu trúc dương tính với LYVE1. ( E và F ) Độ phóng đại cao và thấp tương ứng của hạch ba nhánh, trong đó các tế bào T dương tính với CD3 được tìm thấy ở giữa các tế bào hạch và—tương tự như các hình ảnh khác—gần với các tế bào dương tính với LYVE1 dài trong mô liên kết. Hình G cho thấy mặt cắt ngang của một động mạch có kích thước trung bình, với VW đánh dấu màu vàng, trong đó các tế bào dương tính với LYVE1 đang nàm ở cả nhu mô não và bên ngoài mạch máu. Chúng có mặt ở vỏ ngoài mạch máu. Khoảng trống giữa não và mạch máu chứa đầy tế bào T (màu đỏ), một số ít gắn ở bên ngoài thành mạch. H cho thấy một vòng mạch máu ở thể vân được bao phủ hoàn toàn bởi các tế bào T. Hình ảnh là một cấp của ngăn xếp Z hiển thị các chế độ xem bên trên Top và Left . (Thanh tỷ lệ: A , G và H , 9 μm; B và C , 16 μm; D , 90 μm; E , 80 μm; F , 20 μm.)
Hình 7: Xác nhận kết quả bằng chất đánh dấu yếu tố bạch huyết thứ hai, podoplanin. Phần những người mắc bệnh thần kinh ( A – D ), hoặc không mắc bệnh thần kinh ( E – H ). Các mẫu được lấy từ hạch nền, vỏ đỉnh và xoang hang bao gồm hạch ba nhánh và dây thần kinh. A – C là hình ảnh của cùng một khu vực sử dụng các bộ lọc huỳnh quang khác nhau. A hiển thị lớp phủ của DAPI hạt nhân (màu xanh); trong các tế bào B , T được đánh dấu CD3 (màu xanh lá cây) và nội mô mạch máu được biểu hiện bằng kháng thể đối với yếu tố von Willebrand (màu đỏ) và dấu hiệu nội mô bạch huyết, podoplanin (màu vàng) trong khối cầu nhạt. Có thể nhìn thấy bên ngoài mạch trong nhu mô ( B ) được bao phủ bởi các tế bào T huỳnh quang màu xanh lá cây (CD3) được gắn vào ( C ) màng ngoài dương tính với podoplanin (màu vàng). Các dấu hoa thị gắn nhãn mạch máu; các mũi tên chỉ vào các vòng mạch trong nhu mô (nhuộm DAPI ở A cho thấy sự hiện diện của các tế bào thần kinh, trong khi ở B chỉ nhìn thấy được các tế bào T). D cho thấy sự tiếp tục của một khoang quanh mạch máu (xem trong Hình nhỏ ở góc dưới bên phải ) được mở rộng (xem hình chữ nhật trong Hình nhỏ với mũi tên lớn màu trắng chỉ vào vùng được mở rộng) nơi có thể quan sát được các tế bào T xanh dương tính với CD3 (đầu mũi tên) gắn dọc theo màng dương tính podoplanin (màu vàng) (mũi tên nhỏ) của tế bào nội mô. E là một phần của một nhánh của dây thần kinh ba nhánh, trong đó yếu tố bám dính ICAM1 được nhuộm màu xanh lá cây và các tế bào T màu đỏ được gắn vào các sợi dương tính với ICAM1. F – H chứng minh một phần của hạch ba nhánh có các tế bào hạch (dấu hoa thị) để hiển thị sự chồng chéo của PDPN (màu vàng), ICAM1 (màu xanh lá cây) và các tế bào T dương tính với CD3 (màu đỏ) liền kề với cả hai. Điều thú vị là ICAM1 ( G ) được biểu hiện bằng các tế bào vệ tinh bao quanh các tế bào hạch, nhưng chỉ xung quanh một phần tế bào thần kinh. Trong H , là một lát cắt quang học của phần, các mặt bên biểu thị rõ ràng mức độ gần nhau của các cấu trúc màu xanh lá cây (biểu hiện ICAM1) và màu vàng (biểu hiện PDPN) với các tế bào T màu đỏ. (Thanh tỷ lệ: A – C , 75 μm; D , 30 μm, D ( Inset ), 25 μm, E – H , 20 μm.)
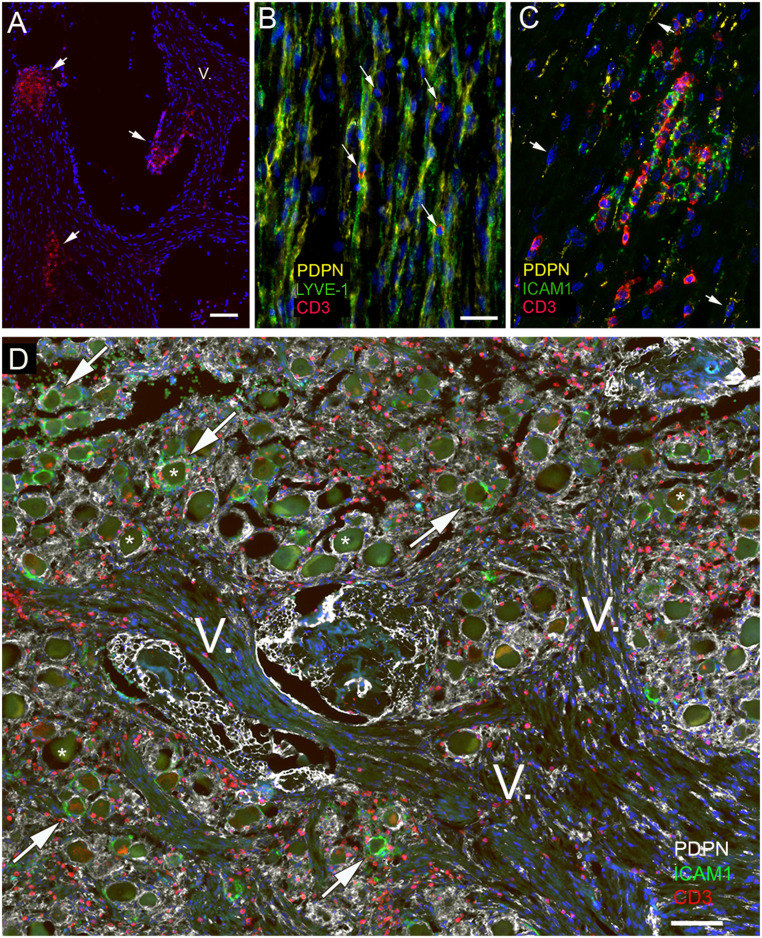
Sự tích tụ tế bào T được nhìn thấy ở nơi các nhánh thần kinh bị cắt (Hình 8A), cho thấy sự hiện diện của chúng trong khoang quanh dây thần kinh. LYVE1 và PDPN được tập trung trong các tế bào và các quá trình của bó dây thần kinh và tế bào T luôn ở gần các tế bào dương tính với dấu hiệu bạch huyết này (Hình 8B). Trong bó dây thần kinh, nơi các tế bào T tích lũy trong số các tế bào dương tính với PDPN, ICAM1 cũng được biểu hiện cao (Hình 8 C và D). Một phần của hạch ba nhánh và các nhánh của dây thần kinh thứ năm được thể hiện trong hình 8D. PDPN được nhuộm thường bao quanh các tế bào hạch (một số được đánh dấu bằng các ngôi sao) và cũng được tìm thấy xung quanh và trong các bó dây thần kinh của dây thần kinh sọ thứ năm (được đánh dấu bằng chữ V). Nhiều tế bào T dương tính với CD3 có thể nhìn thấy được ở tất cả các khu vực này. ICAM1 cũng hiện diện trong một phần tế bào dương tính với PDPN và các tế bào xung quanh tế bào hạch. Trong các tế bào hạch ba nhánh và các nhánh của dây thần kinh ba nhánh, tế bào T cũng có mặt trong tất cả các mẫu mà chúng tôi đã kiểm tra, nhưng chúng tôi thấy một số lượng đặc biệt lớn ở hai người chết vì tự thắt cổ. Để kiểm soát hóa mô miễn dịch, chúng tôi đã tìm kiếm và tìm thấy sự tập trung của LYVE1 và VEGFR3. Loại thứ hai là một dấu hiệu nội mô bạch huyết khác đã được biết đến. Chúng tôi đã thực hiện khuếch đại TSA trong trường hợp không có kháng thể chính làm đối chứng âm tính đối với nhuộm màu. Cuối cùng, tính đặc hiệu của kháng thể LYVE1 cũng được xác nhận bằng cách chứng minh rằng nó cũng được biểu hiện trong các đại thực bào liên quan đến rào cản có thể được CD163 dán nhãn cụ thể, như được mô tả trong tài liệu.
Hình 8.: Biểu hiện của các phân tử bám dính liên quan đến tế bào T và các dấu hiệu bạch huyết ở dây thần kinh ba nhánh. Tất cả các bảng đều là của các đối tượng không có bệnh thần kinh nào được biết đến. Dây thần kinh ba nhánh được nhuộm để tìm CD3 (màu đỏ), Lyve1 (màu xanh lá cây) và podoplanin (màu vàng). Hình A cho thấy một nhóm tế bào T ở bề mặt cắt của các bó dây thần kinh (mũi tên ngắn) cho thấy sự tích tụ của các tế bào T dưới màng bào thần kinh bao phủ dây thần kinh. Một nhánh của dây thần kinh sọ thứ năm được đánh dấu bằng chữ số La Mã V. B thể hiện sự tập trung của hai dấu hiệu bạch huyết (podoplanin và Lyve1) trong mô liên kết nội mô và cho thấy các tế bào T (mũi tên) bên cạnh màng nhuộm kép. Trong C , màu vàng tượng trưng cho PDPN và khu vực tập hợp các tế bào T màu đỏ (CD3 dương tính) cũng biểu hiện mạnh mẽ phân tử bám dính ICAM1 (hiển thị bằng màu xanh lá cây). Một số tế bào biểu hiện PDPN có nhân dài được chỉ vào bằng mũi tên. ICAM1 dường như được biểu hiện ở gần các tế bào T. Trong hình D , mặt cắt ngang của hạch ba nhánh và các nhánh ba nhánh từ một nạn nhân bị siết cổ được thể hiện để chứng minh sự tích tụ tế bào T. Nhuộm ba lần cho thấy podoplanin (màu trắng); ICAM1, phân tử bám dính được biết là có liên quan đến sự bám dính/di chuyển của tế bào T (màu xanh lá cây); và CD3 (màu đỏ) dán nhãn cho tất cả các tế bào T. Các tế bào hạch lớn (một số được đánh dấu bằng các ngôi sao) hiện rõ giữa các sợi. Lưu ý rằng—tương tự như hình 7—chỉ một số tế bào hạch được bao quanh bởi các tế bào vệ tinh màu xanh lá cây dương tính với ICAM1 (một số trong số này được chỉ ra bằng mũi tên), trong khi tất cả các tế bào vệ tinh khác không bị nhiễm ICAM1 nhưng vẫn được nhuộm PDPN (màu vàng). (Thanh tỷ lệ: A và D , 100 µm; B và C , 50 µm.
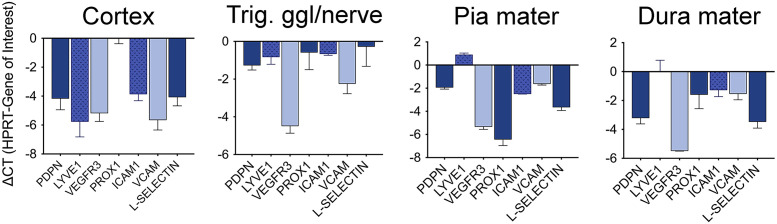
PCR xác nhận sự hiện diện của protein mRNA. Để xác thực các nghiên cứu hóa mô miễn dịch, chúng tôi đã sử dụng qPCR để tìm kiếm các mRNA mã hóa các kháng nguyên mà chúng tôi đã phát hiện được. Với mục đích này, chúng tôi đã lấy mô của màng mềm, màng cứng, các mẫu vỏ não được sử dụng để tạo miễn dịch và ba hạch và dây thần kinh ba nhánh từ ngân hàng não Maryland và chuẩn bị RNA từ chúng. Chúng tôi đã tìm kiếm sự hiện diện của PDPN, LYVE1, VEGFR3, PROX1, ICAM1, VCAM1 và L-Selectin (CD62-L). Các mồi SYBR Green có độ đặc hiệu cao cho thấy rằng các mRNA có lượng vừa phải đến rất phong phú trong tất cả các mẫu não và hạch được thử nghiệm. Kết quả được thể hiện ở hình 9 và được biểu thị bằng những thay đổi lần so với gen giữ nhà (HPRT).
Hình 9: Phân tích qPCR hạch ba nhánh và dây thần kinh, vỏ não và màng não để xác nhận sự hiện diện của mRNA mã hóa các protein được nghiên cứu. Trong các mẫu từ ba nhà tài trợ khác nhau cho các mẫu ba nhánh và các mẫu riêng lẻ của các vùng khác từ mô được sử dụng cho hóa mô miễn dịch, các mRNA mã hóa tất cả các protein mà chúng tôi hình dung bằng cách sử dụng phương pháp nhuộm miễn dịch cũng có mặt, xác nhận biểu hiện của chúng.
Thảo luận
Chúng tôi đã nghiên cứu và mô tả sự phân bố các dấu hiệu cụ thể của tế bào nội mô bạch huyết trong các mô của não và tủy sống con người. Chúng tôi làm điều này để tìm hiểu làm thế nào chất lỏng kẽ trong não có thể đến được màng cứng và khoang dưới nhện. Chúng tôi tin rằng các đường thoát ra hội tụ ở các dây thần kinh sọ và cột sống và kết thúc ở hệ bạch huyết khu vực ngay khi chúng thoát ra khỏi vòm sọ. Con đường này cho phép não tự loại bỏ các chất thải và đảm bảo dòng chảy ra ngoài cho CSF được sản xuất liên tục.
Trong tài liệu liên quan có sự nhầm lẫn thuật ngữ của không gian mạch máu và nhu mô não. Lớp màng mềm đi theo động mạch vào nhu mô não và tạo thành một lớp dày một tế bào liên tục. Lớp này có khả năng thẩm thấu đối với các chất hòa tan và các tế bào miễn dịch (nhưng không phải hồng cầu) có thể đi qua nó. Lớp phủ mao mạch không hoàn chỉnh. Mạch máu được ngăn cách với màng đáy bởi màng đáy nội mô (bao gồm cả các tế bào ngoại vi nằm rải rác) giữa các tế bào cơ trơn trong các mạch lớn hơn, cũng như bởi các tế bào thần kinh đệm, được hình thành bởi các quá trình tế bào hình sao xung quanh mạch máu.
Bạch huyết và khoang quanh mạch máu. khoang quanh mạch máu được mô tả lần đầu tiên bởi Pestalozzi vào năm 1849 và sau đó là Virchow vào năm 1851 và Robin vào năm 1859. Ngày nay, chúng được gọi là không gian Virchow–Robin (VRS). khoang quanh mạch máu động mạch và tĩnh mạch bao quanh các mạch xuyên não, từ khoang dưới nhện đến đường nội mô của chúng. Những khoảng trống này chứa dịch kẽ và tham gia vào quá trình thanh thải chất lỏng và chất thải trao đổi chất ra khỏi não. Gần đây chúng đã được đổi tên thành hệ thống glymphatic.
Năm 1910, Mott và cộng sự của ông cho rằng có một lớp bạch huyết bao quanh các mạch máu trong não liên tục với lớp vỏ và được tạo thành từ các tế bào hình thoi. Lớp vỏ này tạo thành bề mặt mạch máu của khoang quanh mạch máu và mặt ngoài của nó được mô tả bằng màng mềm bao phủ mô thần kinh. Ông gọi đây là một hệ thống bạch huyết quanh mạch tiếp giáp nhau. Những khoang này dường như tương tự như “khoang chứa dịch bao quanh các mạch máu ở não” được Woollam và Millen mô tả năm 1955.
Vào năm 1976, Cserr và cộng sự đã chỉ ra tầm quan trọng của khoang quanh mạch máu trong chuyển động của dịch kẽ và so sánh khoang quanh mạch máu ở não với hệ bạch huyết của các cơ quan khác. Földi và cộng sự đã mô tả một hệ thống các kênh liên kết bao quanh các mạch máu não và cho biết các “tiền bạch huyết” nội sọ này dẫn lưu vào các mạch bạch huyết ngoài sọ được ngăn cách bởi các van ở lỗ tĩnh mạch cảnh. Vào năm 1983, kết quả thí nghiệm được mô tả bởi Csanda và các các cộng sự cho thấy rằng việc tiêm máu vào bể lớn của chó dẫn đến sự tích tụ tế bào hồng cầu ở phần trên của hạch bạch huyết cổ trên, và các mẫu khám nghiệm tử thi của bệnh nhân thu được 2 tuần sau khi họ chết vì chảy máu dưới nhện cho thấy sự hiện diện hemosiderin trong các hạch bạch huyết cổ tử cung. Một con đường tương tự đã được xác nhận ở chó thông qua việc theo dõi các sản phẩm phân hủy có khả năng sử dụng sudanophil sau khi cấy một thanh yttrium phóng xạ vào não .
Trong thập kỷ qua, mối quan tâm mới về hệ bạch huyết não trở nên sôi nổi. Nhóm Needergard, mô tả giả thuyết glymphatic của họ, cho rằng có một lối rộng trong não giữa mạch máu và chân của các tế bào hình sao để loại bỏ chất thải kẽ từ nhu mô não. Chất thải cuối cùng sẽ được dẫn tới các hạch và mạch bạch huyết cổ tử cung.
Các mạch bạch huyết đã được mô tả trong màng cứng của con người bởi Andres và các cộng sự. vào năm 1987 và gần đây được xác nhận bởi Aspelund và Louveau. Các tác giả của một nghiên cứu gần đây đã sử dụng hình ảnh MRI của con người và tìm kiếm con đường đào thải trong cơ thể. Sau khi tiêm chất cản quang vào trong vỏ não, họ kết luận rằng màng cứng cạnh dọc cạnh xoang dọc trên đóng vai trò là cầu nối giữa dịch não tủy trong nhu mô não và các mạch bạch huyết màng cứng.
Phát hiện của chúng tôi cho thấy rằng khoang “quanh mạch máu” được mô tả bởi nhiều nhà nghiên cứu trước đó dường như bao gồm các tế bào nội mô biểu hiện hầu hết các dấu hiệu giống nhau mà các tế bào nội mô bạch huyết ngoại vi có: LYVE1, PDPN, VEGF3 và Prox1. LYVE1 là một glycoprotein màng tích hợp loại I. Nó liên kết với hyaluronan hòa tan và hyaluronan cố định. Podoplanin là một glycoprotein thuộc họ protein loại mucin. Chúng tôi chủ yếu dựa vào LYVE1 và PNPN làm điểm đánh dấu vì VEGFR3 quá bừa bãi và Prox1 quá khó phát hiện. Chúng tôi đã tìm thấy các tế bào dương tính với LYVE1 và PDPN ở tất cả các vùng não mà chúng tôi đã kiểm tra. Hai kháng thể dường như nhuộm cùng một tế bào, nhưng các kháng nguyên có sự phân bố nội bào khác nhau. Các tế bào tương tự cũng dương tính với VEGFR3, nhưng nhiều tế bào khác đã bị nhuộm màu bởi kháng thể này. Tất cả các mặt cắt mạch máu được bao quanh bởi các tế bào dương tính với các dấu hiệu bạch huyết. Chúng tôi quan sát thấy sự nhuộm màu quanh dây thần kinh và nội mô ở các mặt cắt dọc và cắt ngang của các bó dây thần kinh, xung quanh các tế bào vệ tinh của hạch ba nhánh, trong màng cứng, trong các mạch ở khoang dưới nhện, trong các tế bào của màng mềm và trong lớp phiêu lưu của các mạch máu lớn ở nhiều vùng não.
Tế bào lympho T trong không gian quanh mạch não. Sau khi tìm thấy các thành phần bạch huyết trong não người, chúng tôi tìm kiếm sự hiện diện và phân bố của tế bào lympho T ở đó để xác định xem các tế bào nội mô bạch huyết và tế bào lympho trong hệ thần kinh trung ương có liên quan với nhau hay không. Các tế bào miễn dịch được biết là có nhiệm vụ theo dõi các tín hiệu nguy hiểm của hệ thần kinh trung ương và đóng vai trò khôi phục cân bằng nội môi của hệ thần kinh trung ương. Các tế bào T, đại thực bào và tế bào đuôi gai có nguồn gốc từ ngoại vi đều tham gia vào quá trình này. Vì 80% tế bào bảo vệ hệ thần kinh trung ương là tế bào T ban đầu chúng tôi đã sử dụng CD3 để tìm kiếm các tế bào này. Tế bào T có thể xâm nhập vào hệ thần kinh trung ương theo một trong ba cách. Chúng có thể vào CSF thông qua đám rối màng đệm, qua khoang Virchow-Robin hoặc qua các tĩnh mạch sau mao mạch. Những tế bào lympho quanh mạch máu này được cho là có chức năng sàng lọc dịch não tủy để tìm các phân tử có khả năng gây hại. Cserr và công sự của cô ấy là những người đầu tiên chứng minh rằng việc truyền một kháng nguyên vào không gian CSF sẽ kích hoạt hệ thống miễn dịch ngoại biên, cho thấy mối liên hệ trực tiếp giữa khoang dưới nhện và ngoại vi. Trong khi một số nhà điều tra đã mô tả các tế bào miễn dịch trong não liên quan đến tình trạng bệnh lý, thì có rất ít thông tin liên quan đến sự hiện diện và chức năng của tế bào T ở đó khi không có bệnh. Rất ít tế bào lympho hiện diện trong bộ não khỏe mạnh và hầu hết trong số này là tế bào T tác động vào bộ nhớ trung tâm.
Sau khi Cserr xuất bản bài báo của mình, các thành viên của các nhóm khác đã đưa ra kết luận tương tự sau khi họ tiêm nhiều loại tác nhân vi khuẩn và virus vào nhu mô não. Một vài đánh giá xuất sắc gần đây tóm tắt những gì đã biết về vai trò của các tế bào miễn dịch trong hệ thần kinh trung ương đối với sức khỏe và bệnh tật cũng như các cơ chế tế bào và phân tử liên quan đến dẫn lưu bạch huyết và vận chuyển tế bào trong hệ thần kinh trung ương. Chúng tôi quan sát thấy các tế bào T dương tính với CD3 hiện diện trong khoang quanh mạch máu của các mạch lớn, trong lớp vỏ của mạch máu và trong số các tế bào của màng nhện. Chúng tôi cũng tìm thấy một số lượng đáng ngạc nhiên các tế bào T trong số các tế bào của hạch Gasser (ba nhánh) và dưới lớp biểu mô, trong bao quanh dây thần kinh và trong số các sợi trục trong dây thần kinh của các nhánh của dây thần kinh ba nhánh.
Sự chuyển động của các tế bào T trong khoang quanh mạch máu được cho là được xác định bởi sự biểu hiện của các phân tử bám dính thích hợp bởi các tế bào nội mô. Chúng tôi đã thực hiện một sàng lọc sơ bộ nhỏ để xem liệu các tế bào biểu mô bạch huyết trong não người có biểu hiện các phân tử bám dính được biết là được tế bào T sử dụng trong các chuyển động xuyên biểu mô của chúng hay không. Chúng tôi nhuộm các phần não bằng VCAM1, ICAM1 và chọn lọc IL62. Các tế bào nội mô biểu hiện dấu hiệu bạch huyết không dương tính với VCAM1 hoặc selectin, nhưng chúng biểu hiện ICAM1, một phân tử bám dính liên kết với LFA1 và được biểu hiện ở hơn 60% tế bào T phân lập từ CSF người. Người ta cũng đã chứng minh in vitro bằng cách sử dụng các tế bào nội mô não chuột rằng đuôi tế bào chất của ICAM1 nội mô là cần thiết để hỗ trợ sự di chuyển qua nội mô của tế bào lympho T.
Dẫn lưu bạch huyết của não người. Liên quan đến việc “dẫn lưu” bạch huyết từ não người, từ lâu người ta đã cho rằng các dây thần kinh sọ rời khỏi nhu mô có thể đóng vai trò là một kết nối khả dĩ giữa khoang dịch não tủy và hệ bạch huyết ngoại biên. Schwalbe là người đầu tiên vào năm 1869 cho rằng các chất đánh dấu được tiêm vào vỏ tủy xuất hiện trong các hạch bạch huyết. Key và Retzius đã chứng minh mối liên hệ giữa khoang dịch não tủy và niêm mạc mũi.
Bruce và Dawson đã xem xét thông tin có sẵn về các khoang bạch huyết cột sống vào năm 1900. Họ nêu bật những công trình tiên phong của His (1875), người đầu tiên đề xuất rằng con đường chính của dòng chảy dịch kẽ não là khoang quanh mạch máu. Sau đó, Key và Retzius và Obersteiner kết luận rằng “các khoang bạch huyết của mô thải ra khắp nơi vào khoang quanh mạch máu và bạch huyết chảy ra theo hướng ngoại vi của dây rốn.” Cả dây thần kinh sọ và cột sống rời khỏi hệ thần kinh trung ương đều được bao quanh bởi một vòng bít của khoang dưới nhện nơi các màng não tiếp xúc tạo thành một không gian hình phễu hoạt động giống như một van: Khi áp suất bên ngoài cao, nó sẽ đóng lại. Nhóm của Cserr đã mô tả sự dẫn lưu của CSF thông qua các con đường chảy ra dọc theo một số dây thần kinh sọ và rễ thần kinh cột sống và kết luận rằng “một quan điểm mới về miễn dịch học thần kinh trung ương nên kết hợp sự giao tiếp liên tục và được điều chỉnh chặt chẽ giữa não và hệ thống miễn dịch”.
Trong các nghiên cứu của, chúng tôi đã phân tích hệ thống ba nhánh trong các mẫu của mẫu ba nhánh xoang hang. Trong tất cả các mẫu mà chúng tôi đã xem xét, thỉnh thoảng có các tế bào T dương tính với CD3 xung quanh các tế bào hạch và các bó dây thần kinh lớn dưới lớp biểu bì, giữa các bó, dưới lớp bao quanh dây thần kinh và trong khoang nội tiết. Chúng tôi phát hiện ra rằng epineurium, perneurium và endeurium (mô liên kết lót các sợi myelin riêng lẻ) đều dương tính với các dấu hiệu bạch huyết cũng như phân tử bám dính, ICAM1. Các tế bào T mà chúng tôi thấy luôn ở gần các tế bào có dấu hiệu bạch huyết và các phân tử bám dính. Chúng tôi đưa ra giả thuyết rằng các tế bào T có thể di chuyển trong những không gian này giống như khi chúng “lăn” trên các tế bào nội mô và chúng có khả năng tham gia quan sát môi trường hệ thần kinh trung ương. Chuyển động của chúng có thể được điều phối bởi sự biểu hiện đồng bộ của phân tử bám dính bởi các tế bào biểu mô bạch huyết và phối tử nhận thức LFA1 của nó, được tạo ra bởi các tế bào miễn dịch. Điều này có thể dẫn đến “dòng” tế bào miễn dịch chậm lại dọc theo dây thần kinh trong khoang quanh mạch máu. Các tế bào có thể được đẩy nhẹ nhàng nhờ sự chuyển động của dịch kẽ/dịch não tủy xung quanh mạch máu hoặc do dịch nội mô chảy giữa các sợi trong dây thần kinh sọ/ngoại biên. Người ta đã gợi ý rằng ICAM1 có thể đóng một vai trò quan trọng trong việc di chuyển các tế bào T trong hệ thần kinh trung ương. Các kháng thể trung hòa đối với ICAM1 và LFA1 làm suy yếu khả năng vượt qua hàng rào nội mô trong hệ thần kinh trung ương của tế bào lympho T. Trong các mẫu từ hai người chết do tự thắt cổ, chúng tôi nhận thấy số lượng tế bào T rất cao dọc theo các nhánh dây thần kinh của dây thần kinh thứ năm so với hai người chết do dùng ma túy quá liều và tai nạn giao thông. Sự chồng chất của các tế bào phía trên đường thắt cổ cho thấy sự di chuyển có hướng của các tế bào T trong dây thần kinh đã bị chặn do bị thắt cổ.
Những kết quả này rất phù hợp với dữ liệu trước đó của Csanda và các cộng sự. Họ cho thấy rằng thực nghiệm tắc nghẽn bạch huyết cổ ở chó dẫn đến phù não và giả thuyết của Cserr rằng có thể có một dòng dịch não tủy/các chất hòa tan dọc theo dây thần kinh sọ tới các mạch bạch huyết ngoại vi. Trong một nghiên cứu gần đây, Ahn và các tác giả khác nhắc đến tầm quan trọng của mạch bạch huyết màng não nền (trái ngược với màng não lưng) trong dẫn lưu dịch não tủy. Mặc dù ông đã nghiên cứu trên chuột, nhưng quan sát này dường như phù hợp với dữ liệu của con người với sự nhấn mạnh đặc biệt đến vai trò tiềm năng của xoang hang kết nối khoang dịch não tủy với hệ bạch huyết ở vùng hầu họng. Goldman và cộng sự đã mô tả quá trình di chuyển của tế bào T từ não tới niêm mạc mũi thông qua tấm nôi trên đường đến các hạch bạch huyết cổ tử cung. Về các đường dẫn lưu CSF từ hệ thần kinh trung ương đến bạch huyết ngoại vi, điều quan trọng cần đề cập đến lỗ sọ, các lỗ ở đáy hộp sọ mà các dây thần kinh sọ và mạch máu đi qua để đến các khu vực có mạng lưới bạch huyết ngoại biên dày đặc chứa 20 đến 30 hạch bạch huyết. Chúng bao gồm tấm sàng (dây thần kinh khứu giác), ống thị giác (dây thần kinh thị giác), lỗ tròn (dây thần kinh hàm trên), lỗ bầu dục (dây thần kinh hàm dưới) và lỗ cảnh, nơi các dây thần kinh thiệt hầu, phế vị và phụ rời khỏi hộp sọ và lỗ rách nối đám rối chân bướm ngoài sọ với xoang hang nội sọ.
Ở người, nhu cầu về các đường thoát ra như vậy được hỗ trợ bởi thực tế là có 340 đến 500 mL CSF được sản xuất hàng ngày. Bất kỳ thời điểm nào, cũng có 140 mL CSF bên trong hộp sọ, 30 mL trong số đó nằm trong hệ thống não thất và 110 mL trong khoang dưới nhện. Chất này được đổi ba lần một ngày. Mặc dù chúng dựa trên một mẫu rất nhỏ (hai đối tượng bị siết cổ so với hai đối tượng chết vì nguyên nhân tự nhiên), nhưng quan sát của chúng tôi cho thấy có sự gia tăng số lượng tế bào T trong hạch ba nhánh và các nhánh thần kinh của những đối tượng chết vì tự thắt cổ, cho thấy khả năng di chuyển có hướng của các tế bào miễn dịch từ không gian hệ thần kinh trung ương ra ngoại vi. Mức độ tích tụ tế bào có thể phụ thuộc vào nhiều yếu tố, chẳng hạn như độ dài của giai đoạn đau đớn, hoàn cảnh tử vong và sức khỏe của mạch máu. Sẽ cần nhiều thời gian hơn để nghiên cứu hiện tượng này. Hệ bạch huyết trong và xung quanh các dây thần kinh sọ [và dây thần kinh cột sống] đóng vai trò quan trọng trong việc vận chuyển các sản phẩm cuối cùng của tế bào thần kinh ra khỏi não. Mỗi dây thần kinh sọ được bao bọc bởi màng não cho đến khi đến lỗ thích hợp để rời khỏi vòm sọ. Do đó, các thành phần bạch huyết mang trong khoang dưới nhện, phần màng não của màng cứng và khoang quanh dây thần kinh có thể đến các mạch bạch huyết cổ trong khoang mũi thông qua dây thần kinh khứu giác, thị giác hoặc ba nhánh.
Một báo cáo gần đây tập trung vào việc liệu kết nối bạch huyết hệ thần kinh trung ương có thể là cơ sở của phản ứng miễn dịch đặc hiệu với kháng nguyên được tạo ra bởi các tế bào T di chuyển từ vùng não bị bệnh đến các hạch bạch huyết cổ tử cung hay không. Nó dường như ủng hộ những phát hiện của chúng tôi về sự di chuyển của tế bào T về phía bạch huyết cổ tử cung. Trong mô hình chuột mắc u nguyên bào thần kinh đệm, các tác giả đã chứng minh rằng việc thắt các hạch bạch huyết cổ trên làm giảm đáng kể tỷ lệ sống sót.
Sử dụng hạch ba nhánh từ ba nhà tài trợ khác nhau (Ngân hàng não Maryland) và các mẫu từ vỏ não, màng não mềm và màng não cứng, chúng tôi đã thực hiện qPCR để phát hiện các mRNA mã hóa các protein mà chúng tôi hình dung bằng cách sử dụng kháng thể và khuếch đại miễn dịch. Các mRNA phân tử bám dính mà chúng tôi đã cố gắng phát hiện (ICAM1, VCAM1 và L-selectin) đều được biểu hiện trong các mô được kiểm tra (Hình 9). Tuy nhiên, chúng tôi chỉ có thể nhuộm thành công các tế bào bằng kháng thể LYVE1, PDPN, VEGFR3 và ICAM1. Sự khác biệt có thể liên quan đến khả năng của các kháng thể sẵn có trong việc liên kết với các kháng nguyên trong vật chất của con người sau khi chết được nhúng vào Paraffin. Cũng có thể, các mRNA không được chuyển hóa thành protein với số lượng đủ để có thể phát hiện được.
Nghiên cứu của chúng tôi chủ yếu dựa trên hình thái học, với các phân tích bổ sung về mẫu não để biểu hiện các mRNA mã hóa các protein mà chúng tôi đã nghiên cứu. Các nghiên cứu qPCR nhằm mục đích hỗ trợ cho kết luận rằng các protein mà chúng tôi phát hiện bằng cách sử dụng phương pháp nhuộm miễn dịch khuếch đại thực sự được biểu hiện trong các mô được kiểm tra. Hầu hết các phát hiện đều phù hợp với dữ liệu tài liệu cũ, danh sách các tài liệu tham khảo lịch sử dọc theo dòng thời gian và cho thấy rằng, ngoài các kênh bạch huyết màng cứng, còn có một mạng lưới quanh mạch máu trong não người cho phép các chất hòa tan, tế bào và dịch ngoại bào di chuyển từ nhu mô ra ngoài sọ, và cuối cùng di chuyển về phía xoang tĩnh mạch và hệ bạch huyết ngoại biên (cổ tử cung). Trong bài giảng Morisonian của mình vào năm 1894, Tuke đã đưa ra một gợi ý tương tự khi nói rằng “mỗi chiếc bình mang theo nó một đoạn kéo dài của màng mềm, bao quanh các chiếc bình cho đến các nhánh cuối cùng của nó. Đây thường được gọi là cơ quan ngoại vi của mạch máu. Từ lớp màng mềm hoặc màng hyaline này, các quy trình được đưa ra để bao bọc các tế bào, do đó mỗi tế bào được bao quanh bởi một bao quanh mạch máu”. Theo kết quả của chúng tôi, không gian này chứa các bề mặt lân cận của tế bào T biểu hiện các dấu hiệu bạch huyết. Kết quả sơ bộ của chúng tôi cho thấy hầu hết các tế bào T này là tế bào lympho CD4. Khi chúng tôi sử dụng CD45, điểm đánh dấu tất cả các tế bào màu trắng, chúng tôi nhận thấy rằng không phải tất cả các tế bào được nhuộm CD45 đều dương tính với CD3. Một số có lẽ là đại thực bào, cũng có trong những khoang này. Chúng tôi không thể nói bất cứ điều gì về cách CSF chảy qua hệ thống bạch huyết não.Dựa trên những quan sát của chúng tôi về vật chất của con người sau khi chết và chúng tôi cũng chưa thể kết nối dữ liệu của mình với giả thuyết hệ bạch huyết. Vì khoang quanh mạch máu thiếu các van mà mạch bạch huyết ngoại biên có nên các chất hòa tan có thể di chuyển đến hoặc ra khỏi não dựa trên sự thay đổi của áp suất. Do đó, các sản phẩm phân hủy của tế bào chết, các mảnh mô hoặc tập hợp protein có thể di chuyển ra khỏi não và các tế bào miễn dịch hoặc mầm bệnh có thể di chuyển đến hoặc đi từ não theo cùng một con đường. Khả năng di chuyển theo hướng như vậy của mầm bệnh ( Listeria ) trong các nhánh dây thần kinh ba nhánh của cừu đã được Charlton và Garcia đề xuất vào năm 1977. Quan sát của chúng tôi về tế bào dương tính với dấu hiệu bạch huyết trong hệ thống ngoại vi ba nhánh phù hợp với đề xuất này.
Gần đây, đã có nhiều dữ liệu hơn về hệ thống glymphatic có thể có trong não người: Thomas và các công sự đã tóm tắt kết quả thực nghiệm về động lực học chất lỏng của CSF trong khoang quanh mạch máu và vai trò của chúng trong việc loại bỏ các sản phẩm thải khỏi hệ thần kinh trung ương. Hầu hết các nghiên cứu cho thấy vai trò của nhịp đập động mạch trong sự chuyển động của vật liệu trong khoang quanh mạch máu. Raz và cộng sự đã phân tích sự rò rỉ iốt từ các mạch máu sau khi thủng nội mạch trong quá trình lấy huyết khối bằng cách sử dụng các hình ảnh CT nối tiếp ở người. Những quan sát của họ phù hợp với sự tồn tại của hệ thống glymphatic (hoặc một con đường quanh mạch máu tương tự) ở người. Kết luận tương tự đã được đưa ra bởi Meng và các tác giả khác- người đã sử dụng siêu âm để mở BBB sau đó tiêm chất phản quang. Họ mô tả mô hình phân bố chất phản quang trong khoang quanh mạch máu, trong khoang dưới nhện và trong các tĩnh mạch lớn dẫn lưu xoang màng cứng. Trong một nghiên cứu gần đây khác, khoảng trống giữa màng mềm bao quanh thành tĩnh mạch vỏ não được tăng cường và kết nối các bạch huyết màng cứng dọc theo xoang dọc trên, đảm bảo khả năng thoát ra từ hệ thống glymphatic.
Các nghiên cứu bổ sung rất cần thiết để khám phá chức năng của hệ bạch huyết trong não người, đặc tính và thành phần của các tế bào miễn dịch có trong hệ bạch huyết hệ thần kinh trung ương đối với sức khỏe và bệnh tật cũng như các tín hiệu đóng vai trò trong sự tương tác giữa lớp lót tế bào dương tính với dấu hiệu bạch huyết những không gian này và các tế bào di chuyển trong đó. Phát hiện của chúng tôi cũng cho thấy các nhà giải phẫu và bác sĩ lâm sàng làm việc chăm chỉ, có kỷ luật và sâu sắc trước đây, những người không được hưởng lợi từ các phương pháp hiện đại vẫn có thể nhận biết và mô tả các khoảng bạch huyết trong não. Tất cả chúng ta nên học hỏi từ điều này.
Phương pháp
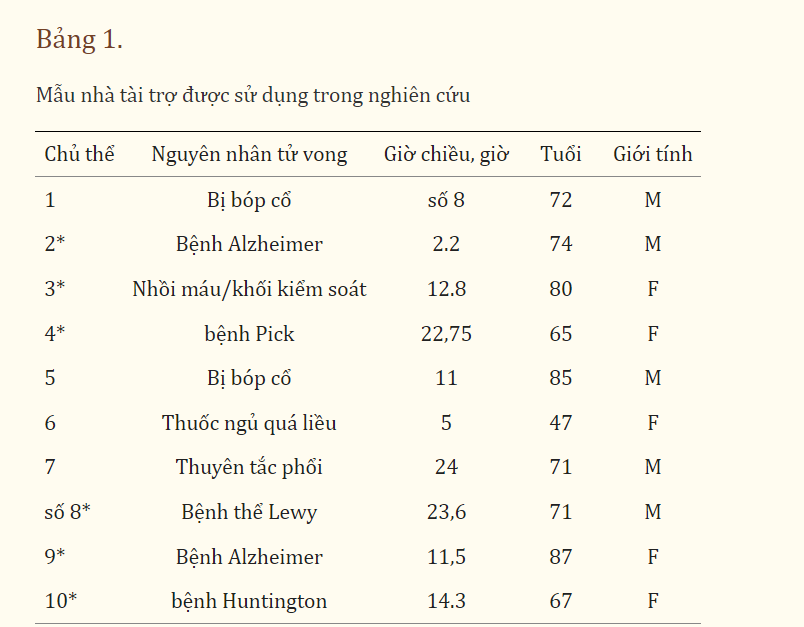
Mẫu não và hạch. Các mẫu não người sau khi chết ẩn danh được lấy từ nhiều nguồn: Ngân hàng mô Harvard tại Bệnh viện McLean (bộ phận paraffin) và Khoa Khoa học Pháp y của Đại học Semmelweis, Budapest, Hungary và các hạch sinh ba bổ sung được lấy từ Ngân hàng mô Maryland. Các khối nhúng parafin từ Bệnh viện McLean có kèm theo các mô tả về bệnh lý thần kinh và chúng tôi đã chọn những khu vực ít bị ảnh hưởng bởi bệnh nhất để xử lý. Ở Hungary, não được mổ xẻ và phân lập được nhiều vùng não, màng não, xoang hang và thân não với các dây thần kinh sọ não. Các mẫu của “xoang hang” được cắt ra từ màng cứng ở phần giữa của hố sọ bao gồm: các dây thần kinh, mạch máu và khoang trong hệ thần kinh của não (Meckeli) được kết nối phía sau với hạch 3 nhánh (Gasseri) và các nhánh thần kinh. Chúng được đông lạnh nhanh hoặc nhúng vào parafin sau khi cố định bằng formalin. Nghiên cứu đã được phê duyệt bởi các quy định đạo đức của Châu Âu dưới sự cho phép TUKEB #189/2015. Các hạch ba nhánh đông lạnh của con người được trung tâm tài nguyên não và dịch tủy sống của con người hiến tặng, chúng được thu thập từ những người hiến tặng ẩn danh trong độ tuổi từ 53 đến 85 tuổi. Thời gian khám nghiệm tử thi trước khi khám nghiệm tử thi thay đổi từ 2,2 đến 24 giờ. Bảng 1 hiển thị các mẫu mà chúng tôi đã kiểm tra và mô tả trong bài báo này.
Các mẫu được dán nhãn dấu hoa thị được cung cấp bởi Bệnh viện McLean. Những cái không được dán nhãn đến từ Đại học Semmelweis ở Budapest, Hungary. PM, khám nghiệm tử thi.
Hóa mô miễn dịch. Các phần được nhúng parafin được khử parafin bằng Safeclear II (Fisher Scientific; #044-192) và được bù nước với nồng độ ethanol giảm dần ngay sau đó bằng phương pháp thu hồi epitope do nhiệt (HIER) trong dung dịch đệm citrat 10 mM ở pH 6,0 bằng lò vi sóng thương mại. Các phiến kính được đặt trong lò vi sóng nằm phẳng trong hộp đựng và được phủ bằng đệm citrate. Chúng được đun sôi ở công suất cao (700 W), sau đó nấu thêm 5 phút nữa ở công suất 50% (350 W). Sau HIER, các phiến kính được để nguội đến nhiệt độ phòng trong bộ đệm. Tiếp theo, dung dịch chặn enzyme nội sinh kép Bloxall (Vector; SP-6000) được áp dụng cho tất cả các phần trong 15 phút trước khi áp dụng các kháng thể chính. Chúng tôi đã sử dụng phương pháp ghi nhãn ghép kênh dựa trên khuếch đại tín hiệu và thuốc nhuộm tyramide huỳnh quang ( 29 ). Ưu điểm của kỹ thuật này là các kháng thể từ cùng một loài có thể được sử dụng liên tiếp vì thuốc nhuộm huỳnh quang liên hợp tyramide không hòa tan trong nước cho phép loại bỏ cả kháng thể sơ cấp và thứ cấp bằng nhiệt. Tín hiệu huỳnh quang đến từ phức hợp tyramide không hòa tan vẫn còn ở vị trí của kháng nguyên mục tiêu. Quá trình này có thể được lặp lại nhiều lần bằng cách sử dụng các fluorochrome khác nhau kết hợp với tyramide. Tín hiệu huỳnh quang phát ra từ phức hợp tyramide HRP-tyramide mạnh hơn đáng kể so với tín hiệu mà kháng thể thứ cấp liên hợp fluorochrome truyền thống mang lại. Tóm lại, các phiến kính được ủ qua đêm ở 4°C với kháng thể chính đầu tiên, sau đó là kháng thể IgG của loài thích hợp. Các IgG này đã được kết hợp trước với một polyme HRP (VisUCyte HRP polymer; Hệ thống R&D). Sau đó, tín hiệu được hiển thị bằng cách thêm các liên hợp tyramide fluorochrom có màu khác nhau, là chất nền có ái lực cao của HRP. Sau khi nhuộm bằng kháng thể chính đầu tiên, chu trình vi sóng được lặp lại, chỉ để lại một tín hiệu tyramide cụ thể. Sau đó, các kháng thể chính bổ sung (và liên hợp fluorochrome tyramide) lần lượt được sử dụng. Cuối cùng, các tyramide fluorochrome khác nhau đã được hình dung. Đối với nhuộm đối chứng, kháng thể chính đã bị bỏ qua, nhưng quá trình khuếch đại bao gồm cả quá trình ủ với các polyme HRP và tyramide-fluorochromes vẫn không thay đổi. Sau khi hoàn thành quy trình, tất cả các phần được nhuộm màu đen Sudan để dập tắt quá trình tự phát huỳnh quang do lipofuscin và sau đó được phân tích bằng kính hiển vi huỳnh quang đảo ngược Leica DMI6000 bằng phần mềm LAX.
PCR từ Cortex, hạch và dây thần kinh sinh ba, và màng não. Để chiết xuất RNA từ chúng, vỏ não người sau khi chết đông lạnh, màng não (từ cùng một khối mà các phần dành cho hóa mô miễn dịch đã được cắt), hạch ba nhánh và các mẫu thần kinh được nghiền thành bột bằng cối và chày, được đồng nhất hóa trong dung dịch TRIzol (Invitrogen) bằng chất đồng nhất Dounce . RNA tạo ra được phân tích và đánh giá chất lượng bằng thiết bị Nanodrop. Thư viện cDNA đã được tổng hợp bằng cách sử dụng Bộ phiên mã ngược cDNA công suất cao (Hệ thống sinh học ứng dụng) theo hướng dẫn của nhà sản xuất. mRNA được định lượng bằng phương pháp PCR, sử dụng Bộ công cụ SensiFast SYBR Hi-ROX (Bioline) với chương trình chạy được đề xuất trong hệ thống PCR thời gian thực StepOnePlus (Hệ thống sinh học ứng dụng). HPRT1 đã được sử dụng làm gen tham chiếu để chuẩn hóa. Chu trình nhiệt được thực hiện trong thiết bị StepOnePlus của Hệ sinh học ứng dụng: 2 phút kích hoạt nhiệt ban đầu ở 95 ° C, sau đó là 40 chu kỳ biến tính 5 giây ở 95 ° C và ủ và mở rộng kết hợp 10 giây ở 60 ° C. Đường cong nóng chảy cuối cùng xác nhận sự hoàn thành của các phản ứng. Dữ liệu được phân tích bằng phần mềm StepOnePlus, được chuẩn hóa thành gen quản lý (HPRT). Không có điều khiển mẫu nào được chạy cho mỗi bộ mồi. Tính toán CT delta đôi đã được thực hiện để xác định các thay đổi về nếp gấp.
Sự ghi nhận
Nghiên cứu này được hỗ trợ bởi Chương trình nghiên cứu nội bộ của Viện nghiên cứu nha khoa và sọ mặt quốc gia (NIDCR), NIH (dự án nội bộ số ZDE000755-01) và Ngân hàng não người, Trường Y Đại học Semmelweis, Hungary. Chúng tôi ghi nhận những bệnh nhân đã hiến tặng mô của họ từ Bộ sưu tập Não McLean và từ Hungary để khám nghiệm tử thi. Chúng tôi cảm ơn cô Maria Bakó (Khoa Giải phẫu, Mô học và Phôi học, Đại học Semmelweiss) vì đã giúp đỡ xử lý mô. Chúng tôi rất biết ơn cô Sharon Key vì công việc đầu tiên của cô trong việc tối ưu hóa các kỹ thuật kết hợp hóa mô miễn dịch. Đặc biệt cảm ơn cô Li Li (NIDCR) vì chuyên môn của cô trong việc xử lý các mô nhúng parafin. Chúng tôi cảm ơn cô Magdolna Toronyay-Kasztner vì sự giúp đỡ xuất sắc của cô trong việc tập hợp bản thảo và danh sách dài các tài liệu tham khảo cũ lại với nhau. Chúng tôi rất biết ơn Tiến sĩ Michael Brownstein đã biên tập bản thảo. Chúng tôi ghi nhận Giáo sư Endre Csanda (đã qua đời cách đây 5 năm) và Giáo sư Samuel Komoly (Trường Đại học Y Pécs) vì những cuộc thảo luận sâu sắc và sáng tạo về hệ bạch huyết và não trong thập kỷ qua. Cuối cùng, chúng tôi biết ơn tất cả các nhà khoa học trong nhiều thế kỷ đã cống hiến thời gian, tâm trí và cuộc sống của họ để giải quyết một trong nhiều câu đố của tự nhiên bằng cách sử dụng các kỹ thuật kém tiên tiến hơn đáng kể so với những gì chúng ta có hiện nay. Với các phương pháp hiện đại, chúng ta không thể làm gì hơn ngoài việc xác nhận kết quả của họ hàng thập kỷ (hoặc thế kỷ) sau đó.
Các nguồn tài liệu tham khảo cho nghiên cứu này:
Crivellato E., Travan L., Ribatti D., The Hippocratic treatise “On glands”: The first document on lymphoid tissue and lymph nodes. Leukemia 21, 591–592 (2007). [PubMed] [Google Scholar]
2. Mascagni P., Vasorum Lymphaticorum Corporis Humani Descriptio e Iconographia (Pazzini Carli, Siena, Italy, 1787). [Google Scholar]
3. Schwalbe G., Der Arachnoidealraum, ein Lymphraum und sein Zusammenhang mit dem Perichorioidealraum. Centralblatt für die medicinischen Wissenschaften 7, 465 (1869). [Google Scholar]
4. Key A., Retzius G., Studien in der Anatomie des Nervensystems und des Bindegewebes (Samson und Wallin, Stockholm, 1875). [Google Scholar]
5. Tuke J. B., The Morisonian Lectures, delivered before the Royal College of Physicians of Edinburgh: Session 1874. Edinburgh Med. J. 20, 687–700 (1875). [PMC free article] [PubMed] [Google Scholar]
6. Bruce A., Dawson J. W., On the relations of the lymphatics of the spinal cord. J. Pathol. Bacteriol. 15, 169–178 (1911). [Google Scholar]
7. Obersteiner H., The Anatomy of the Central Nervous Organs in Health and Disease (Charles Griffin, London, 1900), pp. 174–175. [Google Scholar]
8. Zwillinger H., Die Lymphbahnen des oberen Nasalschnittes und deren Beziehungen zu den perimeningealen Lymphraumen. Arch. Laryngol. und Rhinol. 26, 66–78 (1912). [Google Scholar]
9. Jackson R. T., Tigges J., Arnold W., Subarachnoid space of the CNS, nasal mucosa, and lymphatic system. Arch. Otolaryngol. 105, 180–184 (1979). [PubMed] [Google Scholar]
10. Brierley J. B., Field E. J., The connexions of the spinal sub-arachnoid space with the lymphatic system. J. Anat. 82, 153–166 (1948). [PubMed] [Google Scholar]
11. Koh L., Zakharov A., Johnston M., Integration of the subarachnoid space and lymphatics: Is it time to embrace a new concept of cerebrospinal fluid absorption? Cerebrospinal Fluid Res. 2, 6 (2005). [PMC free article] [PubMed] [Google Scholar]
12. Földi M., et al., New contributions to the anatomical connections of the brain and the lymphatic system. Acta Anat. (Basel) 64, 498–505 (1966). [PubMed] [Google Scholar]
13. Csanda E., Obál F., Obál F. J., “Central nervous system and lymphatic system” in Lymphangiology, Földi M., Casley-Smith J. R., Eds. (Schattauer, Stuttgart, 1983), pp. 475–508. [Google Scholar]
14. Csanda E., Zoltan T. O., Foldi M., Elevation of cerebrospinal-fluid pressure in the dog after obstruction of cervical lymphatic channels. Lancet 1, 832 (1963). [PubMed] [Google Scholar]
15. Cserr H. F., Harling-Berg C. J., Knopf P. M., Drainage of brain extracellular fluid into blood and deep cervical lymph and its immunological significance. Brain Pathol. 2, 269–276 (1992). [PubMed] [Google Scholar]
16. Földi M., The brain and the lymphatic system revisited. Lymphology 32, 40–44 (1999). [PubMed] [Google Scholar]
17. Benveniste H., Lee H., Volkow N. D., The glymphatic pathway: Waste removal from the CNS via cerebrospinal fluid transport. Neuroscientist 23, 454–465 (2017). [PMC free article] [PubMed] [Google Scholar]
18. Iliff J. J., Nedergaard M., Is there a cerebral lymphatic system? Stroke 44(suppl. 1):S93–S95 (2013). [PMC free article] [PubMed] [Google Scholar]
19. Jessen N. A., Munk A. S., Lundgaard I., Nedergaard M., The glymphatic system: A beginner’s guide. Neurochem. Res. 40, 2583–2599 (2015). [PMC free article] [PubMed] [Google Scholar]
20. Weller R. O., Djuanda E., Yow H. Y., Carare R. O., Lymphatic drainage of the brain and the pathophysiology of neurological disease. Acta Neuropathol. 117, 1–14 (2009). [PubMed] [Google Scholar]
21. Plog B. A., Nedergaard M., The glymphatic system in central nervous system health and disease: Past, present, and future. Annu. Rev. Pathol. 13, 379–394 (2018). [PMC free article] [PubMed] [Google Scholar]
22. Johnston M., Armstrong D., Koh L., Possible role of the cavernous sinus veins in cerebrospinal fluid absorption. Cerebrospinal Fluid Res. 4, 3 (2007). [PMC free article] [PubMed] [Google Scholar]
23. Ramirez J., et al., Imaging the perivascular space as a potential biomarker of neurovascular and neurodegenerative diseases. Cell. Mol. Neurobiol. 36, 289–299 (2016). [PubMed] [Google Scholar]
24. Aspelund A., et al., A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. J. Exp. Med. 212, 991–999 (2015). [PMC free article] [PubMed] [Google Scholar]
25. Louveau A., et al., Structural and functional features of central nervous system lymphatic vessels. Nature 523, 337–341 (2015). [PMC free article] [PubMed] [Google Scholar]
26. Absinta M., et al., Human and nonhuman primate meninges harbor lymphatic vessels that can be visualized noninvasively by MRI. eLife 6, e29738 (2017). [PMC free article] [PubMed] [Google Scholar]
27. Ringstad G., Eide P. K., Cerebrospinal fluid tracer efflux to parasagittal dura in humans. Nat. Commun. 11, 354 (2020). [PMC free article] [PubMed] [Google Scholar]
28. Meng Y., et al., Glymphatics visualization after focused ultrasound-induced blood-brain barrier opening in humans. Ann. Neurol. 86, 975–980 (2019). [PubMed] [Google Scholar]
29. Tóth Z. E., Mezey E., Simultaneous visualization of multiple antigens with tyramide signal amplification using antibodies from the same species. J. Histochem. Cytochem. 55, 545–554 (2007). [PubMed] [Google Scholar]
30. Choi J. S., et al., Expression of vascular endothelial growth factor receptor-3 mRNA in the rat developing forebrain and retina. J. Comp. Neurol. 518, 1064–1081 (2010). [PubMed] [Google Scholar]
31. Hou Y., et al., Expression of vascular endothelial growth factor receptor-3 mRNA in the developing rat cerebellum. Cell. Mol. Neurobiol. 31, 7–16 (2011). [PubMed] [Google Scholar]
32. Shin Y. J., Riew T. R., Park J. H., Pak H. J., Lee M. Y., Expression of vascular endothelial growth factor-C (VEGF-C) and its receptor (VEGFR-3) in the glial reaction elicited by human mesenchymal stem cell engraftment in the normal rat brain. J. Histochem. Cytochem. 63, 170–180 (2015). [PMC free article] [PubMed] [Google Scholar]
33. Sun F. J., et al., Elevated expression of VEGF-C and its receptors, VEGFR-2 and VEGFR-3, in patients with mesial temporal lobe epilepsy. J. Mol. Neurosci. 59, 241–250 (2016). [PubMed] [Google Scholar]
34. Pedragosa J., et al., CNS-border associated macrophages respond to acute ischemic stroke attracting granulocytes and promoting vascular leakage. Acta Neuropathol. Commun. 6, 76 (2018). [PMC free article] [PubMed] [Google Scholar]
35. Hutchings M., Weller R. O., Anatomical relationships of the pia mater to cerebral blood vessels in man. J. Neurosurg. 65, 316–325 (1986). [PubMed] [Google Scholar]
36. Morris A. W., et al., Vascular basement membranes as pathways for the passage of fluid into and out of the brain. Acta Neuropathol. 131, 725–736 (2016). [PMC free article] [PubMed] [Google Scholar]
37. Zhang E. T., Inman C. B., Weller R. O., Interrelationships of the pia mater and the perivascular (Virchow-Robin) spaces in the human cerebrum. J. Anat. 170, 111–123 (1990). [PMC free article] [PubMed] [Google Scholar]
38. Engelhardt B., Vajkoczy P., Weller R. O., The movers and shapers in immune privilege of the CNS. Nat. Immunol. 18, 123–131 (2017). [PubMed] [Google Scholar]
39. Pestalozzi R., Ober Aneurysmataspuriaderkleinen Gehirnarterienundihren Zuzammenhang mit Apoplexie (F. E. Thein, Wurtzburg, 1849). [Google Scholar]
40. Virchow R., Tiber die Erweiterung kleinerer Gefasse. Virchows Arch. 3, 427–462 (1851). [Google Scholar]
41. Robin C., Recherches sur quelques particularities de la structure des capillaires de l’encephale l’homme. J. Physiol. 2, 536–548 (1859). [Google Scholar]
42. Mott F. W., Lond M. D., Lond F. R. C. P., The Oliver-Sharpey lectures on the cerebrospinal fluid. Lancet 176, 1–8 (1910). [Google Scholar]
43. Woollam D. H., Millen J. W., The perivascular spaces of the mammalian central nervous system and their relation to the perineuronal and subarachnoid spaces. J. Anat. 89, 193–200 (1955). [PMC free article] [PubMed] [Google Scholar]
44. Cserr H. F., Cooper D. N., Milhorat T. H., “Production, circulation and absorption of brain interstitial fluid” in Dynamics of Brain Edema, Pappius H. M., Feindel W., Eds. (Springer, Berlin, 1976), pp. 95–97. [Google Scholar]
45. Földi M., Csillik B., Zoltán O. T., Lymphatic drainage of the brain. Experientia 24, 1283–1287 (1968). [PubMed] [Google Scholar]
46. Csanda E., et al., Structural, ultrastructural and functional reactions of the brain after implanting yttrium 90 rods used in stereotactic neurosurgery. Acta Neurochir. (Wien), 1977 (suppl. 24), 139–147 (1977). [PubMed] [Google Scholar]
47. Andres K. H., von Düring M., Muszynski K., Schmidt R. F., Nerve fibres and their terminals of the dura mater encephali of the rat. Anat. Embryol. (Berl.) 175, 289–301 (1987). [PubMed] [Google Scholar]
48. Podgrabinska S., et al., Molecular characterization of lymphatic endothelial cells. Proc. Natl. Acad. Sci. U.S.A. 99, 16069–16074 (2002). [PMC free article] [PubMed] [Google Scholar]
49. Ellwardt E., Walsh J. T., Kipnis J., Zipp F., Understanding the role of T cells in CNS homeostasis. Trends Immunol. 37, 154–165 (2016). [PubMed] [Google Scholar]
50. Ousman S. S., Kubes P., Immune surveillance in the central nervous system. Nat. Neurosci. 15, 1096–1101 (2012). [PMC free article] [PubMed] [Google Scholar]
51. Hickey W. F., Leukocyte traffic in the central nervous system: The participants and their roles. Semin. Immunol. 11, 125–137 (1999). [PubMed] [Google Scholar]
52. Kida S., Steart P. V., Zhang E. T., Weller R. O., Perivascular cells act as scavengers in the cerebral perivascular spaces and remain distinct from pericytes, microglia and macrophages. Acta Neuropathol. 85, 646–652 (1993). [PubMed] [Google Scholar]
53. Harling-Berg C., Knopf P. M., Merriam J., Cserr H. F., Role of cervical lymph nodes in the systemic humoral immune response to human serum albumin microinfused into rat cerebrospinal fluid. J. Neuroimmunol. 25, 185–193 (1989). [PubMed] [Google Scholar]
54. Kivisäkk P., Tucky B., Wei T., Campbell J. J., Ransohoff R. M., Human cerebrospinal fluid contains CD4+ memory T cells expressing gut- or skin-specific trafficking determinants: Relevance for immunotherapy. BMC Immunol. 7, 14 (2006). [PMC free article] [PubMed] [Google Scholar]
55. Galea I., Bechmann I., Perry V. H., What is immune privilege (not)? Trends Immunol. 28, 12–18 (2007). [PubMed] [Google Scholar]
56. Prinz M., Priller J., The role of peripheral immune cells in the CNS in steady state and disease. Nat. Neurosci. 20, 136–144 (2017). [PubMed] [Google Scholar]
57. Svenningsson A., et al., Adhesion molecule expression on cerebrospinal fluid T lymphocytes: Evidence for common recruitment mechanisms in multiple sclerosis, aseptic meningitis, and normal controls. Ann. Neurol. 34, 155–161 (1993). [PubMed] [Google Scholar]
58. Lyck R., et al., T-cell interaction with ICAM-1/ICAM-2 double-deficient brain endothelium in vitro: The cytoplasmic tail of endothelial ICAM-1 is necessary for transendothelial migration of T cells. Blood 102, 3675–3683 (2003). [PubMed] [Google Scholar]
59. Marieb E. N., Hoehn K., Human Anatomy and Physiology (Benjamin Cummings, San Francisco, 2009). [Google Scholar]
60. Sobel R. A., Mitchell M. E., Fondren G., Intercellular adhesion molecule-1 (ICAM-1) in cellular immune reactions in the human central nervous system. Am. J. Pathol. 136, 1309–1316 (1990). [PMC free article] [PubMed] [Google Scholar]
61. Engelhardt B., Ransohoff R. M., The ins and outs of T-lymphocyte trafficking to the CNS: Anatomical sites and molecular mechanisms. Trends Immunol. 26, 485–495 (2005). [PubMed] [Google Scholar]
62. Greenwood J., et al., Intracellular domain of brain endothelial intercellular adhesion molecule-1 is essential for T lymphocyte-mediated signaling and migration. J. Immunol. 171, 2099–2108 (2003). [PMC free article] [PubMed] [Google Scholar]
63. Csanda E., Földi M., Obál F., Zoltán O. T., Cerebral oedema as a consequence of experimental cervical lymphatic blockage. Angiologica 5, 55–63 (1968). [PubMed] [Google Scholar]
64. Ahn J. H., et al., Meningeal lymphatic vessels at the skull base drain cerebrospinal fluid. Nature 572, 62–66 (2019). [PubMed] [Google Scholar]
65. Goldmann J., et al., T cells traffic from brain to cervical lymph nodes via the cribroid plate and the nasal mucosa. J. Leukoc. Biol. 80, 797–801 (2006). [PubMed] [Google Scholar]
66. Veening J. G., Barendregt H. P., The regulation of brain states by neuroactive substances distributed via the cerebrospinal fluid; a review. Cerebrospinal Fluid Res. 7, 1 (2010). [PMC free article] [PubMed] [Google Scholar]
67. Song E., et al., VEGF-C-driven lymphatic drainage enables immunosurveillance of brain tumours. Nature 577, 689–694 (2020). [PMC free article] [PubMed] [Google Scholar]
68. Johnston M., Papaiconomou C., Cerebrospinal fluid transport: A lymphatic perspective. News Physiol. Sci. 17, 227–230 (2002). [PubMed] [Google Scholar]
69. Tuke J. B., The Morisonian Lectures, delivered before the Royal College of Physicians of Edinburgh: Session 1894. Edinburgh Med. J. 39, 673–683 (1894). [PMC free article] [PubMed] [Google Scholar]
70. Tuke J. B., Note on the anatomy of the pia mater. Trans. Med. Chir. Soc. Edinb. 1, 118–122 (1882). [PMC free article] [PubMed] [Google Scholar]
71. Iliff J. J., et al., A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β. Sci. Transl. Med. 4, 147ra111 (2012). [PMC free article] [PubMed] [Google Scholar]
72. Charlton K. M., Garcia M. M., Spontaneous listeric encephalitis and neuritis in sheep. Light microscopic studies. Vet. Pathol. 14, 297–313 (1977). [PubMed] [Google Scholar]
73. Thomas J. L., Jacob L., Boisserand L., [Lymphatic system in central nervous system] [in French]. Med. Sci. (Paris) 35, 55–61 (2019). [PubMed] [Google Scholar]
74. Raz E., et al., Possible empirical evidence of glymphatic system on computed tomography after endovascular perforations. World Neurosurg. 134, e400–e404 (2020). [PubMed] [Google Scholar]
75. Naganawa S., Ito R., Taoka T., Yoshida T., Sone M., The space between the pial sheath and the cortical venous wall may connect to the meningeal lymphatics. Magn. Reson. Med. Sci. 19, 1–4 (2020). [PMC free article] [PubMed] [Google Scholar]
Các bài viết liên quan
Thomas Bartholin và hệ bạch huyết
Hiệu quả của việc dẫn lưu bạch huyết bằng tay trong điều trị tích cực giai đoạn I của bệnh phù bạch huyết liên quan đến ung thư vú
Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
Danh mục sản phẩm
-
Hotline mua hàng 096.7786.399
-
Giao hàng miễn phí Đơn hàng >1tr
-
Sản phẩm chính hãng Cam kết chính hãng 100%