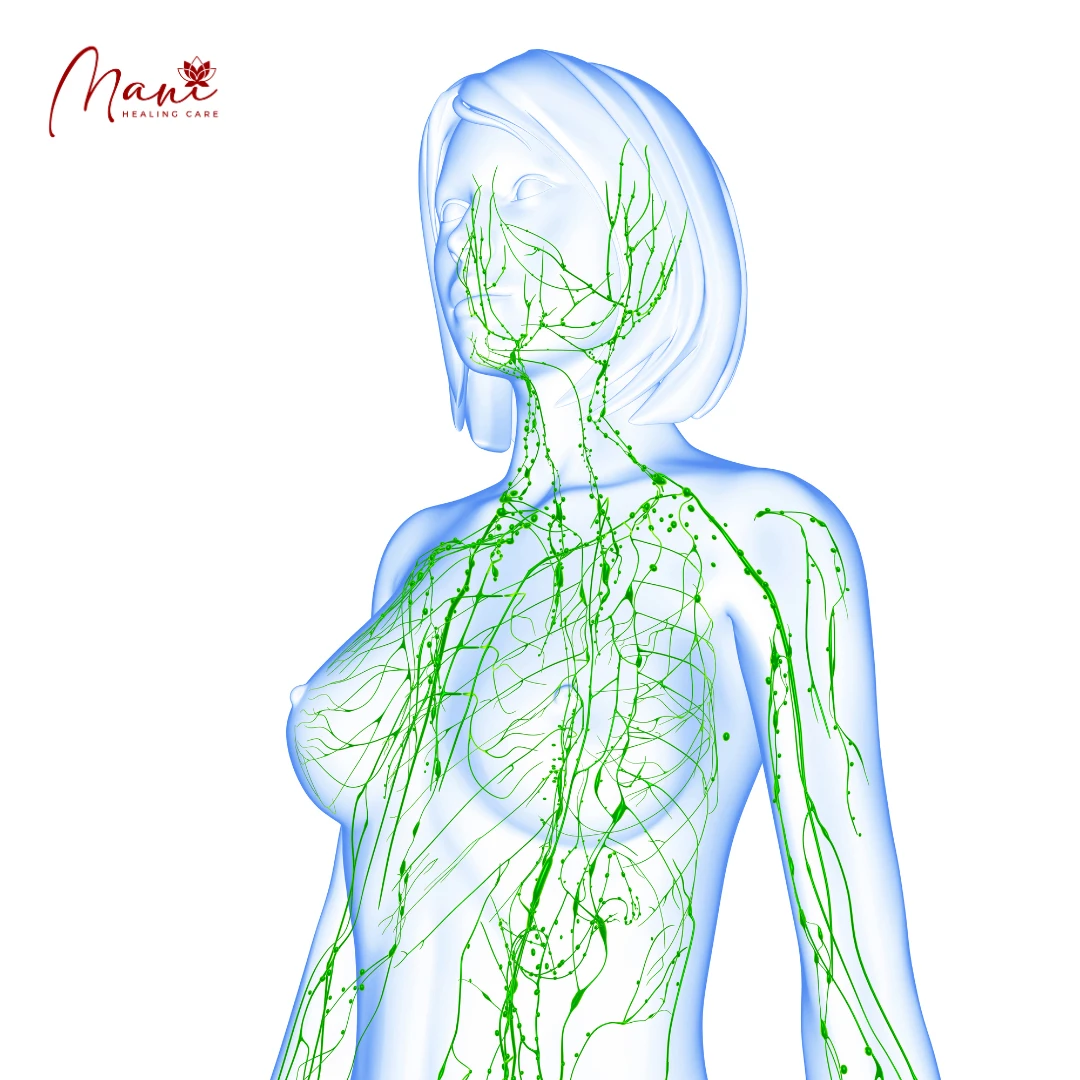
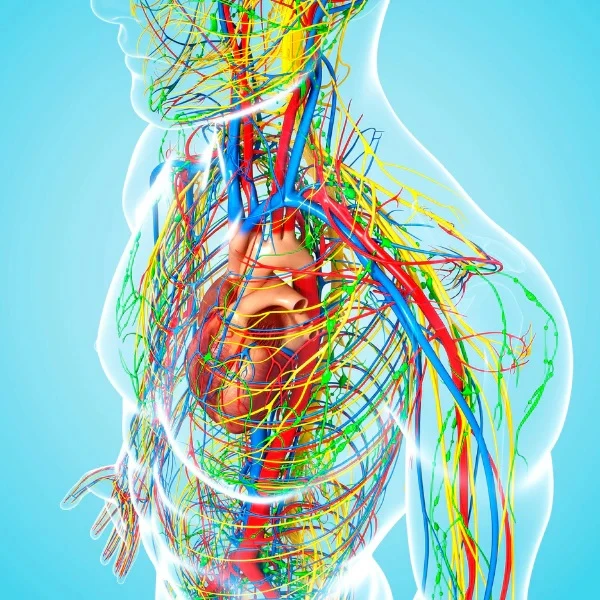
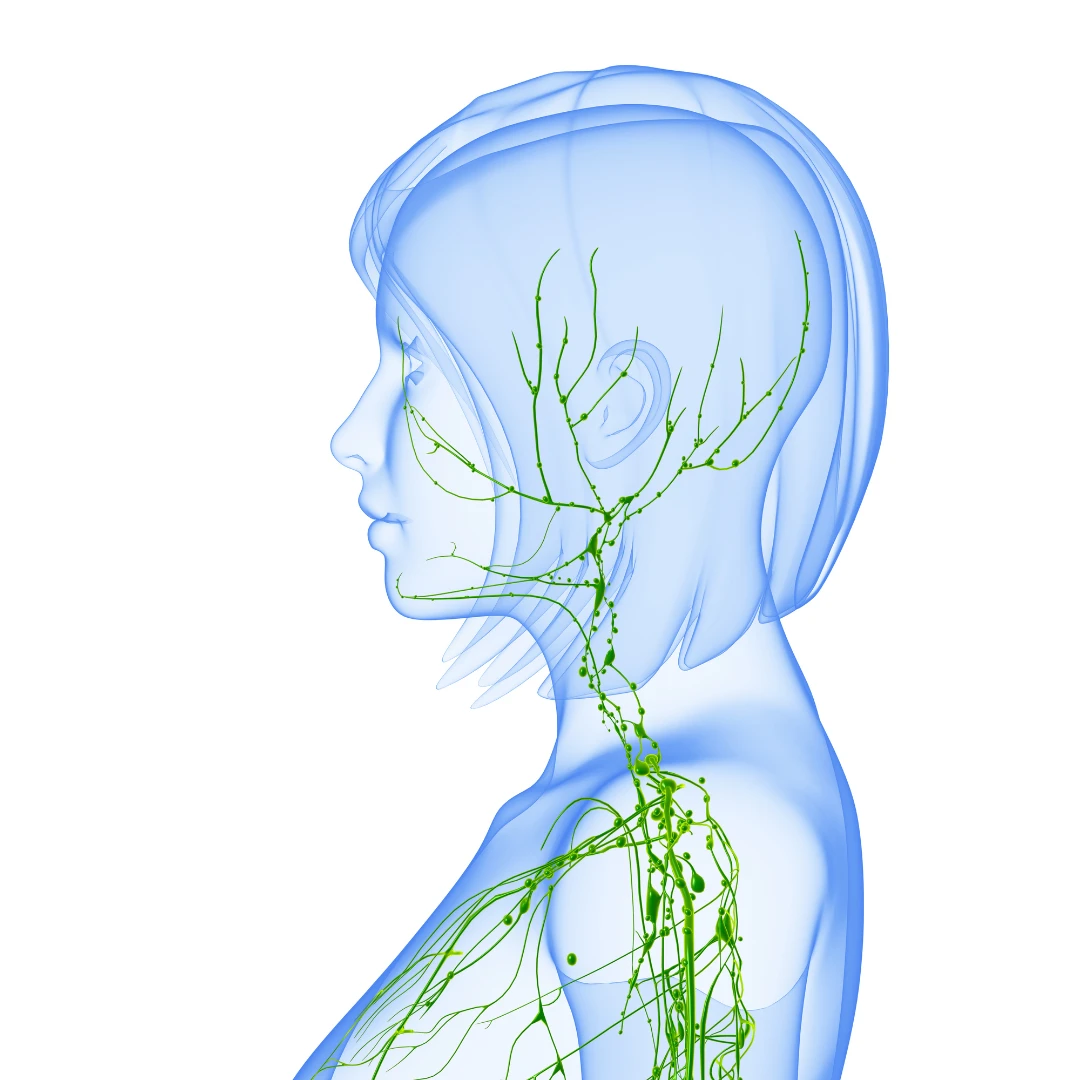
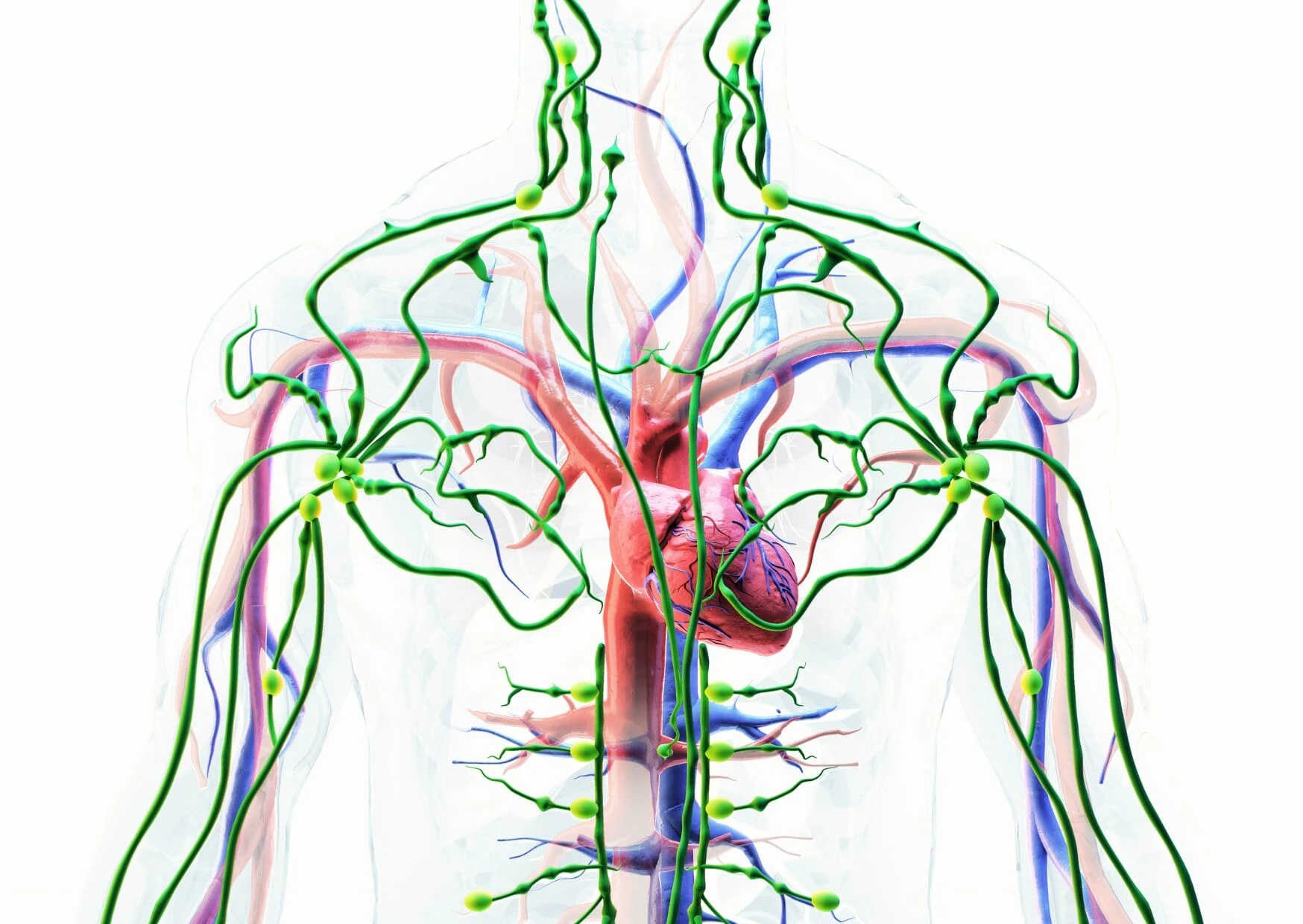
Phát hiện con đường thải độc não bộ bằng MRI
Hệ thống loại bỏ chất thải não được ghi lại bằng MRI tăng cường độ tương phản
Nội dung chính [hiện]
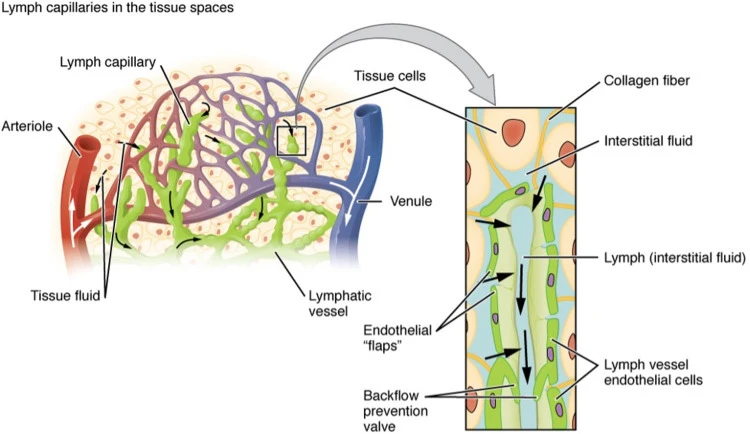
Hệ thống hệ bạch huyết não là một con đường cận mạch máu được xác định để trao đổi dịch não tủy (CSF) và dịch kẽ (ISF), tạo điều kiện thuận lợi cho việc loại bỏ các chất hòa tan và chất thải hiệu quả khỏi não, sau đó các chất này được loại bỏ khỏi não dọc theo các con đường cạnh tĩnh mạch. Bởi vì độ thanh thải amyloid β hòa tan phụ thuộc vào chức năng của con đường hệ bạch huyết não, chúng tôi đề xuất rằng sự ứ trệ của hệ thống thanh thải này sẽ góp phần vào sự lắng đọng mảng bám amyloid và sự tiến triển của bệnh Alzheimer. Ở đây chúng tôi cung cấp bằng chứng về chức năng của con đường hệ bạch huyết não có thể được đo bằng cách sử dụng một kỹ thuật hình ảnh có liên quan đến lâm sàng. Hình ảnh toàn bộ não cho phép xác định hai đường chính ở hốc tuyến yên và tuyến tùng, trong khi MRI cho phép xác định các thông số động học đơn giản để mô tả đặc điểm của CSF hệ bạch huyết não – Chúng tôi đề xuất rằng phương pháp MRI này có thể cung cấp cơ sở để đánh giá tính nhạy cảm và tiến triển của bệnh Alzheimer trong não người còn sống.
- Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
- Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
- Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
- Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
- Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Làm thế nào amyloid, giấc ngủ và trí nhớ có sự liên quan?
Bệnh lý bệnh Alzheimer (AD), được đặc trưng bởi sự lắng đọng Aβ trong não dưới dạng các mảng ngoại bào không hòa tan và sự kết tụ tau nội bào trong các sợi xoắn ốc theo cặp, bắt đầu phát triển ~ 10–15 năm trước khi bắt đầu suy giảm trí nhớ. Trong những năm gần đây, một trọng tâm của nghiên cứu AD là xác định giai đoạn tiền lâm sàng của AD, khi Aβ có hoặc không có sự lắng đọng tại vỏ não mới bắt đầu xảy ra, nhưng trước khi nhận thức rõ ràng. Mục tiêu cuối cùng là can thiệp trị liệu ở giai đoạn này để ngăn chặn tiến triển thành AD có triệu chứng. Bệnh lý AD từ lâu đã được cho là có liên quan đến suy giảm trí nhớ ở người lớn tuổi, nhưng bằng chứng gần đây cũng cho thấy sự lắng đọng Aβ có liên quan đến sự gián đoạn chất lượng giấc ngủ. ngay cả khi không có suy giảm nhận thức. Hơn nữa, bằng chứng gần đây ủng hộ vai trò của giấc ngủ trong sự phát triển của AD, ít nhất một phần bằng cách ảnh hưởng đến Aβ. Aβ dao động theo ngày: nồng độ Aβ hòa tan cao hơn khi thức và thấp hơn khi ngủ. Thiếu ngủ làm tăng tốc độ lắng đọng Aβ ở chuột biến đổi gen APP, trong khi thiếu orexin sẽ làm giảm chất lượng giấc ngủ.
Ngoài ra, sự lắng đọng amyloid làm gián đoạn giấc ngủ ở chuột biến đổi gen APP. Do đó mối quan hệ giữa giấc ngủ và sự lắng đọng Aβ đã được đề xuất là hai chiều: sự gián đoạn giấc ngủ dẫn đến sự tích tụ protein và sự lắng đọng protein dẫn đến rối loạn giấc ngủ.Mối quan hệ giữa sự lắng đọng Aβ, có ảnh hưởng tới bệnh lý AD, giấc ngủ và suy giảm trí nhớ chưa được xác định rõ ở người.
Trong số này của tạp chí Nature Neuroscience, Mander và cộng sự báo cáo mối liên hệ giữa sự lắng đọng Aβ trong não, giấc ngủ và rối loạn chức năng trí nhớ. Họ phát hiện ra rằng sự tích lũy Aβ ở vỏ não trước trán giữa (mPFC) có liên quan đến hoạt động sóng chậm bị suy giảm (SWA) trong giấc ngủ không REM (NREM), điều này có liên quan nhiều hơn đến mức độ suy giảm khả năng củng cố trí nhớ phụ thuộc vào vùng đồi thị qua đêm ở người lớn tuổi.
Để nghiên cứu sâu hơn xem liệu sự lắng đọng amyloid chứ không phải teo não có tác động tương tự hay không, các tác giả đã tuyển dụng 26 người lớn tuổi có nhận thức bình thường, những người này đã trải qua chụp cắt lớp phát xạ positron với hợp chất Pittsburgh B để xác định lượng fibrillar Aβ tích tụ trong não. Để đánh giá chức năng bộ nhớ, tất cả những người tham gia đã luyện tập một tập hợp các cặp từ vào buổi tối. Sau đó, giấc ngủ được theo dõi qua đêm bằng phương pháp đo đa ký giấc ngủ để đánh giá các giai đoạn giấc ngủ khác nhau, chẳng hạn như giấc ngủ NREM và thu được điện não đồ (EEG) để phân tích.
Các tác giả nhận thấy rằng lắng đọng amyloid cao hơn trong mPFC tương quan với việc giảm NREM SWA ở vùng não này, nhưng không liên quan đến tần số hoạt động EEG cao hơn hoặc giảm NREM SWA ở các vùng khác, ngay cả sau khi kiểm soát độ tuổi và giới tính. Sau đó, các tác giả đã tìm cách xác định sự tương tác của các yếu tố này bằng cách sử dụng phân tích đường dẫn. Ba mô hình đã được xây dựng để xác định bản chất của sự tương tác giữa các yếu tố. Sử dụng các tham số cho mPFC amyloid, SWA, kích hoạt vùng đồi thị và duy trì bộ nhớ, mô hình phù hợp nhất về mặt thống kê được đưa ra là mô hình phụ thuộc vào giấc ngủ trong đó ảnh hưởng của mPFC fibrillar Aβ sự lắng đọng trong khả năng duy trì trí nhớ bị suy giảm không trực tiếp mà qua trung gian giấc ngủ, ngụ ý mối quan hệ nhân quả.
Amyloid-β và tau: tác nhân và viên đạn trong cơ chế bệnh sinh của bệnh Alzheimer
Các đặc điểm xác định của bệnh Alzheimer (AD) bao gồm những thay đổi dễ thấy trong cả mô học và hành vi của não. Bộ não AD được đặc trưng dưới kính hiển vi bởi sự hiện diện kết hợp của 2 loại cấu trúc bất thường, các mảng amyloid ngoại bào và các đám rối sợi thần kinh nội thần kinh, cả hai đều bao gồm các chất khó hòa tan, các sợi dày đặc. Các khối xây dựng hòa tan của các cấu trúc này là các peptide amyloid-β (Aβ) cho các mảng và tau cho các đám rối. Các peptide Amyloid-β là các mảnh phân giải protein của protein tiền chất amyloid xuyên màng, trong khi tau là một sợi trục đặc hiệu cho não -protein liên quan đến vi ống được làm đầy. Các triệu chứng hành vi của bệnh AD tương quan với sự tích tụ các mảng và đám rối, và chúng là hậu quả trực tiếp của sự tổn thương và phá hủy các khớp thần kinh trung gian trí nhớ và nhận thức. Mất khớp thần kinh có thể do sự suy giảm khả năng sống.
Trong hàng chục năm qua, nhiều bằng chứng được tích lũy đều đặn đã chỉ ra rằng các dạng Aβ và tau hòa tan phối hợp với nhau, sự tích tụ của chúng thành các mảng và đám rối, thúc đẩy các tế bào thần kinh khỏe mạnh hoạt động. Trạng thái bệnh tật và các đặc tính độc hại đặc trưng của Aβ cần có tau. Ví dụ, tế bào thần kinh chết cấp tính, tế bào thần kinh chết chậm sau khi tái nhập vào chu kỳ tế bào ngoài tử cung và rối loạn chức năng khớp thần kinh được kích hoạt bởi các loài Aβ ngoại bào hòa tan và phụ thuộc vào tau hòa tan trong tế bào chất. Do đó, Aβ ngược dòng với tau trong sinh bệnh học AD và kích hoạt sự chuyển đổi tau từ trạng thái bình thường sang trạng thái độc hại, nhưng cũng có bằng chứng cho thấy tau độc hại làm tăng độc tính của Aβ thông qua một vòng phản hồi. lan truyền và lan truyền khắp não bằng các cơ chế giống như prion, can thiệp trị liệu thành công cho bệnh AD sẽ được hưởng lợi từ việc phát hiện các loài này trước khi các mảng bám, đám rối và suy giảm nhận thức trở nên rõ ràng và khỏi việc can thiệp vào các con đường sinh hóa phá hủy mà chúng bắt đầu.
Những thay đổi bệnh lý do amyloid-β gây ra trong bệnh Alzheimer
Các dấu hiệu bệnh lý của bệnh Alzheimer (AD) bao gồm mảng bám do tuổi già, rối loạn sợi thần kinh (NFT), mất khớp thần kinh và thoái hóa thần kinh. Mảng bám tuổi già và NFT được hình thành bằng cách tích tụ amyloid-β (Aβ) và tau tăng phosphoryl hóa tương ứng. Rối loạn chức năng và mất khớp thần kinh tiến triển có mối tương quan chặt chẽ với sự thiếu hụt nhận thức ở AD. Dựa trên các nghiên cứu về các gen chịu trách nhiệm về AD gia đình và các kiểu thay đổi bệnh lý theo thời gian trong não AD, sự tích lũy Aβ được cho là một sự kiện chính ảnh hưởng đến các bệnh lý AD khác trong dòng phát triển của AD. Tuy nhiên, chi tiết về tác dụng của Aβ trên các bệnh lý AD khác vẫn chưa được hiểu rõ. Trong bài đánh giá này, chúng tôi cung cấp cái nhìn tổng quan về tác động của Aβ trong não AD, đặc biệt tập trung vào rối loạn chức năng khớp thần kinh và microglia. Gần đây, chúng tôi đã phát hiện ra sự tích lũy bất thường của một phân tử quan trọng để lắp ráp Actin trong NFT của não AD và người ta tiết lộ rằng sự tích lũy này không chỉ đòi hỏi bệnh lý tau mà còn cả gánh nặng Aβ trong một nghiên cứu sử dụng mô hình chuột biến đổi gen của AD. Tính toàn vẹn của khớp thần kinh được duy trì về mặt hình thái nhờ sự điều chỉnh chính xác của quá trình lắp ráp Actin. Do đó, kết quả cho thấy khả năng Aβ có thể thúc đẩy sự trưởng thành của NFT và gây ra rối loạn chức năng khớp thần kinh thông qua sự xáo trộn của quá trình lắp ráp Actin. Do đó Aβ dường như là yếu tố thúc đẩy quá trình lão hóa não. Mặt khác, chúng tôi đã nghiên cứu khả năng thực bào của vi mô đệm để tạo ra phản ứng bệnh lý bù đắp cho sự tích lũy Aβ. Các nghiên cứu sâu hơn về các bệnh lý AD phụ thuộc vào Aβ có thể góp phần xác định các cơ chế mới về phát triển AD và các mục tiêu điều trị mới trong AD.
Các bài viết liên quan
Thomas Bartholin và hệ bạch huyết
Hiệu quả của việc dẫn lưu bạch huyết bằng tay trong điều trị tích cực giai đoạn I của bệnh phù bạch huyết liên quan đến ung thư vú
Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
Danh mục sản phẩm
-
Hotline mua hàng 096.7786.399
-
Giao hàng miễn phí Đơn hàng >1tr
-
Sản phẩm chính hãng Cam kết chính hãng 100%