Nghiên cứu vai trò tái tạo hệ cơ của hệ bạch huyết trong việc tái tạo mô tim ở cá ngựa vằn – ứng dụng trong điều trị nhồi máu cơ tim và các bệnh lý tim mạch khác
Tác giả: Xidi Feng , Stanislao Travisano, Caroline A. Pearson, Ching-Ling Lien, và Michael RM Harrison
- Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
- Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
- Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
- Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
- Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Thời gian xuất bản: Ngày 19 tháng 2 năm 2021
Nguồn tài liệu: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7922492/
Tóm tắt
Nội dung chính [hiện]
Bệnh tim vẫn là nguyên nhân gây tử vong lớn nhất ở các nước phát triển và các biện pháp can thiệp trị liệu mới là rất cần thiết để giảm bớt nguy cơ ngày càng tăng này. Hệ thống bạch huyết tim của hệ thống mạch máu mạch vành từ lâu đã bị bỏ qua, nhưng nó đóng vai trò quan trọng trong việc cân bằng nội môi và bệnh tật. Gần đây, mạch bạch huyết tìm ở cá ngựa vằn đã được mô tả và vai trò của nó trong việc hỗ trợ phản ứng tái tạo mạnh mẽ của mô tim cá ngựa vằn đã được nghiên cứu. Trong nghiên cứu này, chúng tôi thảo luận về những phát hiện này trong bối cảnh rộng hơn về sự phát triển, tiến hóa của bạch huyết và hứa hẹn hệ thống này sẽ mở ra những hướng điều trị mới để điều trị nhồi máu cơ tim và các bệnh lý tim mạch khác.
1. Giới thiệu
1.1. Hệ thống bạch huyết: Khám phá và chức năng
Vào thế kỷ thứ 5 trước Công nguyên, Hippocrates đã mô tả sự hiện diện của các hạch chứa chất lỏng màu trắng đục (chyle) ở các vùng cơ quan dưới da và sâu cụ thể của cơ thể [ 1 ]. Thông qua những nỗ lực dũng cảm của một nhóm các nhà giải phẫu học, bao gồm Thomas Bartholin, Olaus Rudbeck và George Joyliffe, “các mạch bạch huyết” đã được xác định. Tuy nhiên, phải đến thế kỷ 18, công trình của Mascagni và những người khác mới đánh giá cao. Các mạch và hạch chứa bạch huyết này là một phần không thể thiếu của một mạng lưới, kéo dài từ các mao mạch bạch huyết bị mù (hoặc các mạch bạch huyết ban đầu) ) để thu thập các mạch bạch huyết mà cuối cùng kết nối với hệ thống tuần hoàn máu. So với hệ tuần hoàn máu, sự hiểu biết về vai trò và sự phát triển của hệ bạch huyết còn chậm. Điều này một phần là do mạng lưới này rất mỏng và phần lớn là vô hình so với hệ thống tuần hoàn máu bị huyết áp. Thuật ngữ bạch huyết được đặt ra để phản ánh đặc tính này đến từ Nữ thần Hy Lạp, một nhân vật gắn liền với dòng suối trong vắt. Vị thần La Mã Lympha, có nghĩa là suối nước trong. Ngay cả với sự phát triển của nghiên cứu bằng kính hiển vi, các nghiên cứu về hệ bạch huyết vẫn bị cản trở nghiêm trọng bởi sự thiếu hụt các dấu hiệu và nhãn phân tử tốt. Giống như mạch máu rất cần thiết cho việc cung cấp oxy và chất dinh dưỡng bên cạnh việc loại bỏ chất thải, mạch bạch huyết cũng cung cấp sự hỗ trợ quan trọng cho các mô khỏe mạnh. Khi phạm vi nghiên cứu kỹ thuật và công nghệ mạch bạch huyết được mở rộng, sự hiểu biết của chúng ta về vai trò quan trọng của hệ thống này trong cân bằng nội mô mô và bệnh tật cũng tăng theo.
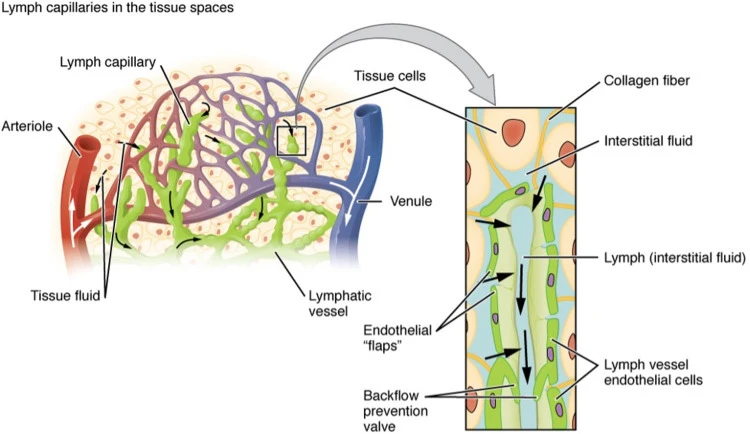
Hệ thống bạch huyết cung cấp một ống dẫn một chiều cho dòng chất lỏng thiết yếu từ mô kẽ trở lại hệ thống tuần hoàn. Sự điều hòa chất lỏng này cực kỳ quan trọng và dị tật (phù bạch huyết nguyên phát) hoặc gián đoạn (phù bạch huyết thứ phát) của các mạch bạch huyết sẽ dẫn đến tình trạng sưng mô. Dịch bạch huyết này rất giàu protein và cũng chứa các tế bào miễn dịch và kháng nguyên. Thông qua các hệ bạch huyết khác nhau, các hạch bạch huyết tiếp xúc với các phần còn nguyên vẹn hoặc đã bị thoái hóa và các kích thích độc hại. Chúng phải được loại bỏ khỏi chất lỏng trước khi quay trở lại dòng máu. Các nghiên cứu gần đây cho thấy quần thể bạch cầu trung tính và đại thực bào trong hệ bạch huyết ngăn chặn sự lây lan toàn thân của mầm bệnh mô. Đối với các tế bào miễn dịch bẩm sinh này, mạch bạch huyết đóng vai trò quan trọng trong việc hỗ trợ các phản ứng miễn dịch thích nghi. Các tế bào miễn dịch ăn các kháng nguyên lạ sẽ được tiếp xúc với các tế bào lympho trong nút nơi chúng gặp các kháng nguyên để kích hoạt các phản ứng thích nghi. Các mạch bạch huyết không chỉ là một ống dẫn thụ động đồng nhất khắp cơ thể mà còn có vai trò đặc biệt đối với mô, bao gồm cả việc hấp thụ chất béo và vitamin. Các mạch bạch huyết nhung mao ruột, được gọi là lacteal, hấp thụ chất béo trong chế độ ăn uống dưới dạng các hạt chất béo trung tính được gọi là chylomicron được tế bào ruột ruột đóng gói. Sau đó chúng được vận chuyển đến hệ thống máu toàn thân thông qua các mạch thu thập và ống ngực. Kết quả, việc kiểm soát sự hấp thu lipid của tuyến sữa có liên quan đến bệnh béo phì và các di chứng của nó, bao gồm cả tác động lên bệnh tim và chức năng. Tuy nhiên, như chúng ta sẽ thảo luận trong bài đánh giá này, hệ thống bạch huyết cũng có vai trò trực tiếp trong việc hỗ trợ sức khỏe và bệnh tim mạch.
tế bào bạch huyết1.2 Sự phát triển của hệ thống bạch huyết
Hầu hết các động vật không xương sống đều có hệ tuần hoàn hở và không có sự phân biệt giữa hệ thống bạch huyết và hệ thống máu hoặc các chức năng tương ứng của chúng. Động vật có xương sống có nhiều đặc điểm của hệ bạch huyết, bao gồm mạch bạch huyết, hạch bạch huyết, cơ quan bạch huyết và các mô dường như ngày càng trở nên khác biệt và chuyên biệt. Cá không hàm và sụn thiếu mạch bạch huyết. Tuy nhiên, một số xoang có thành mỏng cung cấp đường dẫn dịch ngoại bào quay trở lại tĩnh mạch ở những động vật có xương sống bậc thấp này. Ở các động vật có xương sống khác, mạch bạch huyết có các vùng co bóp, hỗ trợ tích cực dòng bạch huyết chảy vào tuần hoàn tĩnh mạch. Cái gọi là tim bạch huyết đã được xác định ở cá phổi, động vật lưỡng cư, bò sát và một số loài chim không biết bay. Chúng thường được tìm thấy ở điểm nối giữa hệ thống bạch huyết và tĩnh mạch và đã bị mất ở động vật có xương sống bậc cao. Hệ bạch huyết thường thiếu tim bạch huyết tương tự như ở động vật có vú được tìm thấy ở các loài cá xương khác. Tuy nhiên, mối liên hệ của hệ bạch huyết này với hệ tuần hoàn máu dường như khác nhau giữa các loài xương và hệ cơ quan. Ở cá hồi và cá thủy tinh, mối liên hệ giữa động mạch với hệ thống máu đã được mô tả và chất lỏng của các hệ thống mạch máu thứ cấp này có thể được tưới máu trong điều kiện thiếu oxy. Cá ngựa vằn đã được chứng minh là có hệ bạch huyết rộng khắp cơ thể, và các phân tích về hệ thống mạch máu của cá ngựa vằn cho thấy nó có nhiều đặc điểm giải phẫu được bảo tồn với hệ thống động vật có vú. Hệ thống cá ngựa vằn có van hai lá kết nối tĩnh mạch nhưng thiếu các nút, phản ánh sự chuyên môn hóa của hệ thống ngày càng tăng, có khả năng tồn tại sự liên kết giữa các mạch máu và bạch huyết giữa các loài teleost. Tuy nhiên, cá ngựa vằn đã cung cấp cái nhìn sâu sắc vô giá về sự điều hòa phân tử của sự phát triển bạch huyết và cung cấp một mối liên hệ tiến hóa hấp dẫn để đạt được sự hiểu biết sâu sắc về chức năng bạch huyết trong bệnh tật.
1.3. Hệ thống bạch huyết của cá ngựa vằn
Phần lớn nghiên cứu tập trung vào sự phát triển bạch huyết của cá ngựa vằn trong giai đoạn phôi thai, tận dụng các công cụ chuyển gen và truy tìm khác nhau cũng như độ trong suốt của cơ thể. Sự hình thành bạch huyết của mạng lưới bạch huyết thân, bạch huyết mặt và ruột đã được mô tả rõ ràng ở phôi cá ngựa vằn. Nguyên bào bạch huyết của mạch bạch huyết thân có nguồn gốc từ tĩnh mạch chủ sau và di chuyển đến vùng cơ lưng để trở thành nguyên bào bạch huyết cạnh dây chằng sau 2 ngày thụ tinh. Những nguyên bào bạch huyết này di chuyển dọc theo các động mạch gian bào ở mặt lưng và bụng, tạo thành các mạch bạch huyết gian bào. Mạch bạch huyết thân cá tiếp tục phát triển để hình thành ống ngực dưới động mạch chủ lưng và mạch bạch huyết dọc lưng dọc theo mạch nối dọc lưng dài.
Sự phát triển của các mạch bạch huyết ở mặt bắt đầu từ sự nảy chồi của các nguyên bào bạch huyết từ tĩnh mạch chủ chung, tạo thành tế bào bạch huyết ở mặt (FLS) sau 36 giờ sau khi thụ tinh. Tế bào bạch huyết di chuyển dọc theo xoang nguyên phát (PHS) về phía vùng đầu. Sự hình thành các mạch bạch huyết ở mặt không phải từ một nguồn nguyên bào bạch huyết duy nhất. Khi tế bào bạch huyết di chuyển, các nguyên bào bạch huyết có nguồn gốc từ PHS và động mạch chủ bụng tham gia tế bào bạch huyết, tạo thành một mạng lưới bạch huyết phức tạp ở mặt.
Nguồn gốc của bạch huyết đường ruột chưa được xác định. Có một mạch bạch huyết lớn liên kết với toàn bộ ruột cá ngựa vằn, cho thấy hệ bạch huyết trong ruột cũng đóng vai trò vận chuyển chất béo như ở động vật có vú. Không giống như các mạch bạch huyết ở thân, di chuyển dọc theo động mạch, các mạch bạch huyết ở ruột được phát hiện hình thành dọc theo cả động mạch và tĩnh mạch. Điều này cho thấy rằng có thể có các tín hiệu dành riêng cho hướng dẫn di chuyển của tế bào nội mô bạch huyết (tế bào nội mô bạch huyết).
Mặc dù sự phát triển của hệ bạch huyết đã được nghiên cứu kỹ lưỡng ở phôi cá ngựa vằn, nhưng các nghiên cứu chức năng của mạch bạch huyết trong mô hình tái tạo và bệnh tật ở các cơ quan khác nhau vẫn còn ở giai đoạn sơ khai. Trong bài đánh giá này, chúng tôi sẽ thảo luận về nghiên cứu gần đây về mạch bạch huyết ở tim của cá ngựa vằn trong quá trình tái tạo tim và ý nghĩa của nghiên cứu này đối với sự hiểu biết của chúng ta về vai trò của mạch bạch huyết trong bệnh tim.
2. Sự phát triển của hệ bạch huyết
2.1. Nguồn gốc tĩnh mạch và không tĩnh mạch
Mạch bạch huyết bao gồm một mạng lưới các tế bào nội mô bạch huyết được tìm thấy ở gần nhưng tách biệt với mạch máu. Sau khi thực hiện các thí nghiệm tiêm mực vào phôi lợn, Florence Sabin đưa ra giả thuyết rằng phần lớn các mạch bạch huyết phát triển từ nội mô của tĩnh mạch và các mạch bạch huyết nguyên thủy này sau đó lan rộng khắp toàn bộ cơ thể phôi để tạo ra mạng lưới bạch huyết. Tuy nhiên, sau khi tiêm dọc theo động mạch chủ, cô cũng kết luận rằng, dù nảy chồi từ tĩnh mạch nhưng bạch huyết sâu vẫn theo động mạch. Các nghiên cứu về dòng tế bào và thí nghiệm ghép ở chim đã xác nhận các nguồn khác nhau của hệ thống mạch bạch huyết. Các phần sâu hơn của túi bạch huyết cảnh có nguồn gốc từ các đoạn tĩnh mạch cảnh của tĩnh mạch chính và các mạch bạch huyết ở da, bề ngoài từ các nguyên bào lympho cục bộ ở da, trong khi tế bào nội mô bạch huyết của tim bạch huyết có nguồn gốc từ cơ thể.
Mạch bạch huyết tim đầu tiên được mô tả trong phôi người phát triển từ hai mạng lưới chằng chịt khác nhau. Đầu tiên gần túi bạch huyết cảnh trái, kéo dài giữa thân phổi và động mạch chủ và đi theo động mạch vành phải. Mạng lưới thứ hai, được mô tả là mạng lưới chính, kết thúc ở túi cảnh bên phải và đi theo động mạch vành trái vào khoảng tuần thứ tám của phôi thai. Điều này trái ngược với chuột, trong đó các mạch bạch huyết của tim đi theo đường đi của tĩnh mạch tim chứ không phải là động mạch vành. Ở cá ngựa vằn, sự phát triển của hệ bạch huyết ở tim xảy ra từ giai đoạn cuối tuổi vị thành niên đến giai đoạn đầu trưởng thành sau hai tháng sau thụ tinh, khi các động mạch vành, cung cấp một một cấu trúc giúp kéo dài các mạch bạch huyết và mở rộng mạng lưới chứ không phải tĩnh mạch. Sự tương đồng giữa sự phát triển bạch huyết ở tim của cá ngựa vằn và con người có thể đại diện cho một cơ chế nguồn gốc các tín hiệu thiết yếu cho nội mô bạch huyết của tim, cơ chế này đã bị thay đổi ở các loài động vật có vú .
Mạch bạch huyết được hình thành bằng cách phát triển từ các tĩnh mạch phôi thai (sự hình thành bạch huyết). Các thí nghiệm truy tìm nguồn gốc ở phôi chuột đã chứng minh rằng hệ bạch huyết có nguồn gốc chủ yếu là tĩnh mạch. Những hình ảnh trong quá trình phát triển phôi cá ngựa vằn đã chứng minh rằng quá trình này được bảo tồn tốt và ít nhất mạch giống như ống ngực chính phát sinh từ phôi thai từ các tĩnh mạch nguyên thủy. Tuy nhiên, việc phát hiện ra nguồn gốc không phải tĩnh mạch của tế bào nội mô bạch huyết ở động vật có vú góp phần tạo nên mạch bạch huyết ở da, mạc treo và tim đã thay đổi sự hiểu biết về cơ chế phát triển mạch bạch huyết của phôi. Hơn nữa, bằng chứng về một nguồn gốc bạch huyết không tĩnh mạch, được đặt tên là “nguyên bào bạch huyết động mạch chủ bụng” (VA-L), được phát hiện là làm phát sinh bạch huyết vùng mặt ở cá ngựa vằn, cho thấy nguồn gốc và sự phát triển của mạch bạch huyết phụ thuộc vào bối cảnh mô.
2.2. Cơ chế phân tử của nhận dạng tế bào nội mô bạch huyết
Sự cân bằng giữa các chất điều tiết tế bào nội mô, Notch, Coup-TFII (Nr2f2) và Prox1 có thể đóng một vai trò quan trọng trong việc hình thành tế bào nội mô (EC) trong quá trình phát triển mạch máu và đặc điểm hình thành của tế bào bạch huyết-động mạch . Tín hiệu Notch(một họ protein trên bề mặt của tế bào) thúc đẩy sự phân biệt tế bào nội mô động mạch, trong khi ở tế bào nội mô tĩnh mạch, hoạt động Notch bị ức chế bởi thụ thể hạt nhân COUP-TFII để duy trì nhận dạng tĩnh mạch. Đặc điểm của tế bào nội mô bạch huyết ở động vật có vú phụ thuộc vào PROX1, một yếu tố rất quan trọng để duy trì sự đặc tính của nội mô bạch huyết. Các yếu tố phiên mã Sox1 8 , CoupTFII , Gata2 và Hhex đã được phát hiện là có vai trò điều chỉnh biểu hiện Prox1 trong tế bào nội mô bạch huyết của chuột.
Tế bào tế bào nội mô bạch huyết gốc di chuyển khỏi tĩnh mạch chính thông qua hoạt động cận tiết của VEGF-C được biểu hiện bởi trung mô lân cận để hình thành các túi bạch huyết nguyên thủy. tế bào nội mô bạch huyết biểu hiện VEGFR2 và VEGFR3, cũng như đồng thụ thể Neuropilin 2 (NRP2). Người ta cũng chứng minh rằng VEGF-C và VEGF-D hoạt động thông qua thụ thể VEGF 3 (VEGFR-3) để tạo ra sự hình thành mạch bạch huyết . LYVE-1, một trong những protein được biểu hiện ở tế bào tế bào nội mô bạch huyết trưởng thành cũng được biểu hiện trong một tập hợp con EC từ các tĩnh mạch trung tâm lớn và cung cấp tín hiệu đầu tiên về năng lực nội mô bạch huyết.
Tương tự như động vật có vú, các tế bào tiền thân bạch huyết có nguồn gốc từ tĩnh mạch ở cá ngựa vằn có thể thấy được prox1a và sự phát triển của bạch huyết phụ thuộc vào vegfr3 (được gọi là flt4 ở cá ngựa vằn). Tuy nhiên, các yếu tố phiên mã liên quan đến chức năng Coup-TFII (Nr2f2) và Sox18 được phát hiện là không thể thiếu đối với đặc điểm bạch huyết ở cá ngựa vằn. Điều này cho thấy rằng sự gắn kết bạch huyết có thể có phần khác biệt giữa cá ngựa vằn và chuột. Tuy nhiên, người ta không biết liệu các yếu tố Nr2f khác có thể bù đắp cho sự mất mát Nr2f2 hay không.
3. Sự phát triển của hệ bạch huyết tim ở cá ngựa vằn
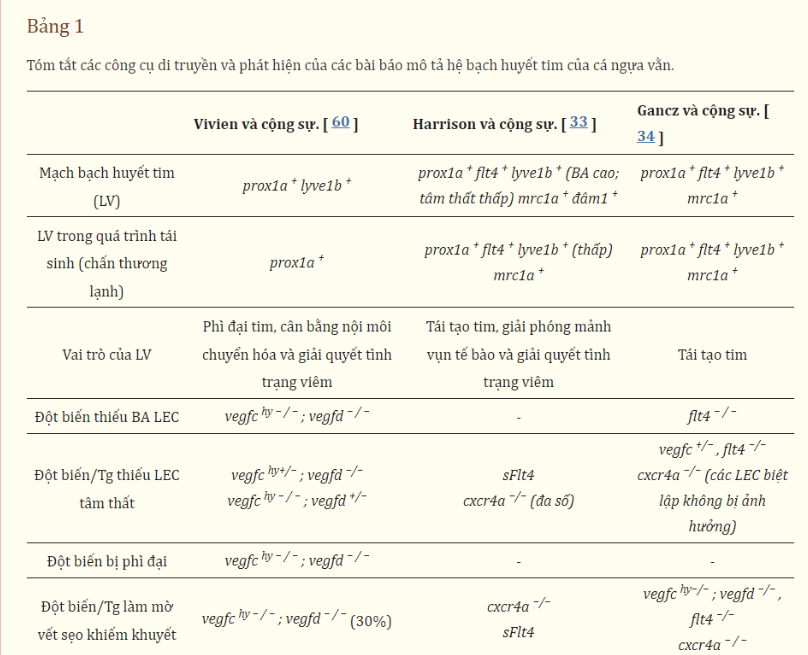
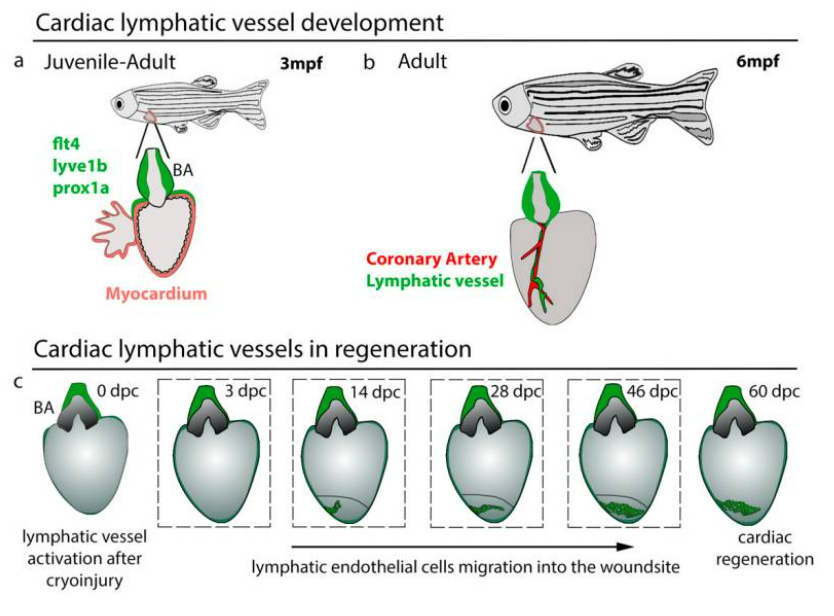
Hệ thống mạch bạch huyết tim ở cá ngựa vằn trưởng thành đã được xác định. Các mạch bạch huyết tim của cá ngựa vằn thể hiện dưới dạng các tế bào nội mô bạch huyết phổ biến, bao gồm prox1a , lyve1b , flt4 và cả mrc1a và Stabit1. Khi các tế bào nội mô bạch huyết của tim di chuyển, 1–5 tế bào đầu tiên được đánh dấu chủ yếu bởi flt4. Không giống như động vật có vú phát triển mạch bạch huyết ở tim ở giai đoạn phôi thai, mạch bạch huyết được phát hiện ở cá ngựa vằn phát triển sau phôi. Các mạch bạch huyết ở tim của cá ngựa vằn phát sinh từ các mạch bạch huyết ở mặt bụng, di chuyển dọc theo động mạch chủ bụng. Các mầm mạch bạch huyết của tim có thể nhìn thấy ở đầu của động mạch cá (BA) trước khi xảy ra bất kỳ sự phát triển mạch vành nào trên tâm thất của cá ngựa vằn.
Sự xuất hiện của các mạch bạch huyết tim trên tim đã được chứng minh là có liên quan đến việc tăng nhịp tim trong quá trình chuyển đổi từ ấu trùng sang giai đoạn trưởng thành. Giảm nhịp tim bằng thuốc chẹn β Atenolol làm suy yếu các mạch bạch huyết của tim trên động mạch chủ và tác động lên nhánh bạch huyết động mạch cá. Động mạch cá là đường thoát ra từ tim cá có buồng thành dày, để điều chỉnh áp lực máu từ tâm thất cá. Các sợi mạch máu trên động mạch cá tiếp tục phát triển và mở rộng để hình thành mạng lưới bạch huyết rộng khắp sau 8 tuần thụ tinh. Các mạch bạch huyết của tim trên động mạch cá vẫn ổn định và không hình thành vào giai đoạn này cho đến giai đoạn trưởng thành trẻ tuổi khi tế bào nội mô bạch huyết xuất hiện trên tâm thất tim vào khoảng 12–16 wpf . Những tế bào này di chuyển và hình thành các mạch dọc theo các động mạch vành chính, được xác minh bằng biểu hiện dll4 , kdrl , flt1 và cxcr4a , cũng như trong mô mỡ dưới thượng tâm mạc. Ý nghĩa chức năng của việc mở rộng thành tế bào mỡ này vẫn chưa được biết, những điều thú vị là sự điều hòa tăng cường các gen chuyển hóa lipid xảy ra ở cá ngựa vằn khiếm khuyết bạch huyết tim, cho thấy rằng các mạch bạch huyết ở cá ngựa vằn cũng có thể có vai trò trong mỡ mô tim. Các mạch bạch huyết ở tim của cá ngựa vằn dường như không có kết nối mở với mạch máu ở trạng thái nghỉ, như được xác nhận bằng cách tiêm vào mạch máu. Tuy nhiên, liệu các kết nối như vậy có tồn tại và mở dưới áp lực hay không vẫn chưa được xác định.
Hình 1: Phát triển và tái tạo mạch bạch huyết tim. ( a ) Các mạch bạch huyết ở tim ( flt4 +, lyve1b +, prox1a +) cư trú trên động mạch cá (BA) bắt đầu di chuyển xuống tâm thất sau 3 tháng sau thụ tinh (mpf) khi cá con trưởng thành. ( b ) Các mạch bạch huyết ở tim đi theo động mạch vành để đến tâm thất. ( c ) Kích hoạt bạch huyết trong quá trình tái tạo tim. Sau chấn thương lạnh, mạch bạch huyết bắt đầu di chuyển vào vết thương sau 14 ngày sau chấn thương lạnh (dpc), trên vị trí vết thương và rất quan trọng để hỗ trợ phản ứng tái tạo.
Sự phát triển của mạch bạch huyết tim cá ngựa vằn phụ thuộc vào tín hiệu Vegfc-Flt4. Việc xóa thụ thể flt4 sẽ ngăn chặn hoàn toàn sự xuất hiện của tế bào nội mô bạch huyết tim trên cả động mạch cá và tâm thất tim. Vì đột biến vegfc gây chết phôi ở cá ngựa vằn, nên sự phụ thuộc vào mạch bạch huyết tim vào Vegfc được mô tả ở các dị hợp tử vegfc . Việc giảm phối tử Vegfc ảnh hưởng đáng kể đến độ bao phủ và phân nhánh bạch huyết trên động mạch cá. Sự hình thành và sự tăng trưởng bị giảm ở các dị hợp tử vegfc. Các kết quả tương tự đã được quan sát thấy ở các đột biến vegfc dị hình trên nền đột biến vegfd. Các mạch bạch huyết ở tim có thể được phát hiện trên động mạch cá ở cá ngựa vằn với một alen vegfc hoặc vegfd chức năng nhưng thiếu tâm thất tim của những con cá ngựa vằn này. Ở các đột biến kép vegfc dị hình và vegfd vô định hình , các mạch bạch huyết tim không có ở cả động mạch cá và tâm thất tim. Để nghiên cứu vai trò của tín hiệu Vegfc trong việc mở rộng mạch bạch huyết của tim để tách biệt các tác động mang tính hệ thống hơn đối với sự phát triển của bạch huyết ở giai đoạn trước, Harrison và cộng sự. đã chặn tín hiệu Vegfc bằng biểu hiện cảm ứng nhiệt của thụ thể Flt4 (sFlt4) hòa tan. Việc tạo ra sflt4 sau khi hình thành các mạch bạch huyết ở tim trên động mạch cá dẫn đến không hình thành mạch bạch huyết trên tâm thất của cá ngựa vằn. Điều này chỉ ra rằng việc mở rộng tâm thất của các mạch bạch huyết đặc biệt yêu cầu tín hiệu Vegfc và bổ sung bất kỳ yêu cầu nào trước đó trong thông số kỹ thuật. Mạch vành cũng cần thiết cho sự phát triển bình thường của mạch bạch huyết ở tim, giúp thúc đẩy sự mở rộng của các mạch bạch huyết lên tâm thất. Sự phát triển quá mức của mạch vành do Phenylhydrazine hydrochloride (PHZ) gây ra cũng thúc đẩy sự phát triển bạch huyết ở tim ở cá ngựa vằn. Ngược lại, ở những đột biến cxcr4a không có mạch vành bình thường, sự phát triển của mạch bạch huyết ở tim cũng bị chặn ở tâm thất. Đáng chú ý, VFL và mạch bạch huyết tim trên động mạch cá không biểu hiện khiếm khuyết rõ ràng ở người đột biến, cho thấy việc thiếu mạch bạch huyết tim mở rộng lên tâm thất chủ yếu là do mất mạch vành.
4. Vai trò của hệ bạch huyết tim trong cân bằng nội môi, bệnh tật và tái sinh của tim
4.1. Vai trò của mạch bạch huyết trong bệnh tim mạch
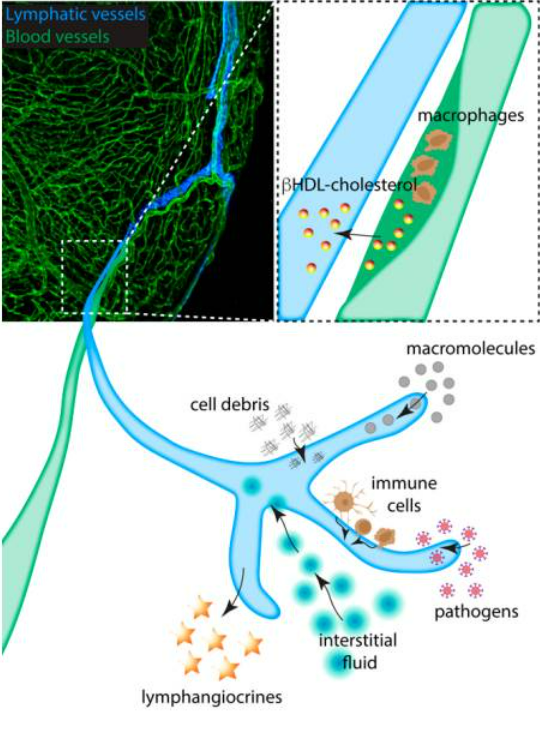
Các mạch bạch huyết đóng vai trò quan trọng trong chuyển hóa chất béo. Hệ bạch huyết ở ruột hấp thụ chất béo trong ăn uống dưới dạng các hạt lipoprotein được gọi là chylomicron để vận chuyển chúng vào máu. Hơn nữa, nội mô bạch huyết là một không gian trao đổi thụ động không thể thiếu cho việc vận chuyển cholesterol. Mặc dù các tế bào cơ trơn mạch máu là loại tế bào chính chịu trách nhiệm hình thành mảng bám trong mô hình xơ vữa động mạch ở chuột, chiếm gần 70% tổng số tế bào mảng bám, giả thuyết cho rằng xơ vữa động mạch là một bệnh viêm mãn tính của thành động mạch đã được chấp nhận rộng rãi. Nồng độ cholesterol trong huyết thanh tăng cao và tăng huyết áp là những yếu tố nguy cơ rất phổ biến đối với bệnh tim mạch. Mặc dù thực tế là các mạch máu xuất hiện thường xuyên hơn các mạch bạch huyết ở lớp collagen bên ngoài (ventitia) bao quanh mảng xơ vữa động mạch vành, các mạch bạch huyết hiện diện nhiều ở các lớp bên trong ( lớp nội mạc và lớp giữa ) của các tổn thương xơ vữa động mạch tiến triển của động mạch vành và sự phát triển của chúng có liên quan với các khu vực được đặc trưng bởi sự lắng đọng canxi rải rác và các tinh thể cholesterol. Ngoài ra, người ta đã chứng minh rằng sự tắc nghẽn cụ thể của VEGFR-3 làm giảm sự kích hoạt mạch bạch huyết và tình trạng viêm tim cục bộ sau khi cấy ghép và có thể được sử dụng như một liệu pháp điều hòa miễn dịch nhắm mục tiêu vào mạch bạch huyết mới. Sự hiểu biết về hệ bạch huyết của tim có thể mang lại những cơ hội mới cho việc can thiệp trị liệu trong tương lai.
Sự tắc nghẽn động mạch vành do mảng xơ vữa động mạch dẫn đến hoại tử cơ tim xung quanh trong các biến cố được gọi là nhồi máu cơ tim (nhồi máu cơ tim). Mô hoại tử sẽ tiếp tục gây ra phản ứng viêm cấp tính, phù nề và tái tạo mô ở vị trí nhồi máu, dẫn đến sẹo xơ, rối loạn nhịp tim và cuối cùng là suy tim. Gần đây, ngày càng có nhiều nghiên cứu chứng minh tầm quan trọng của mạch bạch huyết tim trong nhồi máu cơ tim. Sự hình thành mạch bạch huyết ở vùng nhồi máu đã được quan sát thấy ở chuột nhồi máu cơ tim, chuột nhắt và trong các mẫu bệnh nhân sau nhồi máu cơ tim. Người ta đã chứng minh rằng mạch bạch huyết của tim có vai trò bảo vệ trong quá trình phục hồi sau nhồi máu cơ tim ở chuột. Sự tắc nghẽn tín hiệu VEGF-C bởi chất hòa tan VEGFR3 (sVEGFR3) dẫn đến suy giảm hình thái của các mạch bạch huyết ở tim. Tỷ lệ sống sót ở chuột sVEGFR3 sau nhồi máu cơ tim giảm đáng kể so với nhóm đối chứng Wildtype (WT). Phân tích sâu hơn cho thấy sự gia tăng kích thước vết sẹo và xuất huyết trong cơ tim ở chuột sVEGFR3. Hơn nữa, thành phần vết sẹo được đo bằng MRI không xâm lấn ở chuột sVEGFR3 được phát hiện khác với thành phần vết sẹo ở nhóm đối chứng WT. Apelin (APLN), phối tử của thụ thể APJ kết hợp với G-protein, rất quan trọng đối với sự phát triển của mạch bạch huyết. Việc loại bỏ apelin ở chuột đã ảnh hưởng đến tính liên kết của mối nối tế bào- tế bào trong tế bào nội mô bạch huyết và dẫn đến giãn mạch bạch huyết. Không có mạch bạch huyết tim khỏe mạnh, chuột bị loại apelin phải chịu phản ứng viêm nghiêm trọng hơn sau nhồi máu cơ tim.
Một trong những chức năng quan trọng của mạch bạch huyết là giải phóng tế bào miễn dịch tại vị trí viêm, điều này đã được chứng minh là cần thiết cho tim sau nhồi máu cơ tim. Việc xóa Lyve-1 ở chuột không ảnh hưởng đến sự phát triển tổng thể của mạch bạch huyết nhưng có hại cho việc gắn bạch cầu. Những con chuột đột biến Lyve-1 với khả năng đào thải tế bào miễn dịch bị khiếm khuyết biểu hiện nhiều mô xơ hơn và giảm phần trăm phân suất tống máu LV và thể tích nhát bóp ở tim sau nhồi máu cơ tim.
Bên cạnh chức năng sinh lý trong nhồi máu cơ tim, các mạch bạch huyết ở tim còn tiết ra các phân tử tín hiệu trong việc điều hòa quá trình sửa chữa tim. Lui và cộng sự đã chỉ ra rằng reelin (RELN), một protein mô liên kết ngoại bào chủ yếu được biểu hiện bằng tế bào nội mô bạch huyết của tim, điều chỉnh sự phát triển của tim và thúc đẩy sự tăng sinh tế bào cơ tim (CM) trong quá trình phát triển ở tim chuột. Trong quá trình chữa bệnh tim ở chuột sơ sinh, tác động của Reln gây ra nhiều ở vị trí tổn thương. Việc xóa RELN làm giảm quá chữa bệnh chữa tim với kích thước vết sẹo tăng lên và chức năng tim giảm. Phù hợp với vai trò của nó trong sự phát triển của tim, việc tăng trưởng của tế bào cơ bắp bị giảm và tế bào cơ bắp chết tăng cao ở các đột biến Reln sau cơn đau tim. Các nghiên cứu này cùng nhau cho thấy mạch bạch huyết của tim có vai trò hỗ trợ trong quá trình phục hồi sau nhồi máu cơ tim.
Liệu pháp kích thích tạo mạch bạch huyết ở tim bằng VEGF-C dường như có lợi trong nhồi máu cơ tim. Việc áp dụng VEGF-C đã thúc đẩy quá trình tạo mạch bạch huyết và cải thiện chức năng tim ở cả chuột cống và chuột nhà sau nhồi máu cơ tim. Ở chuột cống được điều trị bằng VEGF-C, tốc độ đào thải tế bào miễn dịch tăng lên, phù tim và lắng đọng collagen giảm. Vai trò của mạch bạch huyết tim trong bệnh tim và sự tái tạo được tóm tắt trong hình 2.
Hình 2: Vai trò của hệ thống bạch huyết tim trong bệnh tim và sự tái tạo. Tắc động mạch vành do mảng xơ vữa gây nhồi máu cơ tim. Mảng bám bao gồm đại thực bào đã xâm nhập và lắng đọng cholesterol; Hệ bạch huyết của tim chạy dọc theo động mạch cung cấp đường dẫn cho cholesterol dưới dạng phức hợp βHDL được loại bỏ khỏi tim và quay trở lại gan. Trong quá trình phát triển, cân bằng nội môi và bệnh tật, bạch huyết của tim sẽ hấp thụ các mảnh vụn tế bào, đại phân tử, tế bào miễn dịch, mầm bệnh và chất lỏng. Việc loại bỏ không hiệu quả có thể dẫn đến tình trạng viêm và xơ hóa do phù nề, gây bất lợi cho kết quả lâm sàng. Hệ thống mạch bạch huyết đáp ứng với sự thiếu hụt đó bằng cách mở rộng các mao mạch bạch huyết sau khi cơ tim bị tổn thương. Các tế bào nội mô bạch huyết cũng là nguồn cung cấp bạch huyết, các protein được bài tiết giúp thúc đẩy quá trình tái tạo và phát triển của mô cơ tim.
4.2. Chức năng của bạch huyết tim trong quá trình tái tạo tim của cá ngựa vằn
So với động vật có vú, cá ngựa vằn có khả năng tái tạo hoàn toàn mô tim sau chấn thương một cách đáng kinh ngạc, khiến nó trở thành mô hình lý tưởng để nghiên cứu chức năng của mạch bạch huyết tim trong quá trình tái tạo tim . Hệ bạch huyết ở tim đã chứng minh, đã có những phản ứng khác biệt khi gặp phải các chấn thương khác nhau. Sau khi cắt cụt, một số trái tim bị hạn chế sự phát triển của mạch bạch huyết tim vào vùng vết thương trong quá trình tái tạo tim. Việc cắt cụt chi ít gây viêm hơn và chỉ lắng đọng collagen/fibrin nhỏ do loại bỏ sạch mô tim. Ngược lại, phản ứng tạo mạch bạch huyết mạnh mẽ được tạo ra ở tim cá ngựa vằn sau chấn thương lạnh, với một số lượng lớn mạch bạch huyết di chuyển vào vùng vết thương và hình thành một mạng lưới với các nhánh tăng lên và đường kính mạch mở rộng. So với cắt cụt, chấn thương lạnh là một mô hình tái tạo tim phức tạp hơn, kết hợp các thành phần hoại tử và viêm, với mô bị thương và ECM vẫn tồn tại ở vùng vết thương. Một phản ứng tương tự xảy ra với vết thương ở vây cho thấy mô hoại tử rất quan trọng đối với sự phát triển của hệ bạch huyết mới sau chấn thương. Phản ứng tạo mạch bạch huyết trong quá trình tái tạo tim cũng được điều chỉnh bằng tín hiệu Vegfc-Flt4. Biểu hiện Vegfc ở tim cá ngựa vằn không thể phát hiện được sau 14 ngày sau khi cắt cụt (dpa) trong khi vẫn có thể phát hiện vùng vết thương ở tim sau 42 ngày sau chấn thương lạnh. Ngoài ra, sự phát triển của mạch bạch huyết ở tim hoàn toàn không có ở các đột biến flt4 và giảm nhiều ở vegfc sau chấn thương lạnh. Phù hợp với phản ứng tạo mạch bạch huyết này, các mạch bạch huyết của tim cũng cho thấy vai trò quan trọng trong việc tái tạo tim sau chấn thương lạnh. Những trái tim có sự phát triển mạch bạch huyết ở tim bị khiếm khuyết, quá trình tái tạo tim sau chấn thương lạnh cũng bị ảnh hưởng so với đối chứng WT; điều này không được thấy ở tim không có mạch bạch huyết, ở tim sau khi cắt cụt. Sự khác biệt trong khả năng tái tạo tim của cá ngựa vằn sau phẫu thuật cắt cụt và chấn thương lạnh cho thấy chấn thương lạnh có thể là mô hình chấn thương phù hợp hơn để nghiên cứu chức năng của mạch bạch huyết tim vì có tình trạng viêm máy chủ và mô hoại tử tại các vị trí nhồi máu ở tim người sau nhồi máu cơ tim.
Các chức năng của mạch bạch huyết tim cá ngựa vằn trong chấn thương lạnh bao gồm: duy trì cân bằng nội môi và giải phóng tế bào miễn dịch. Các mạch bạch huyết của tim có thể hấp thụ Qdots được tiêm vào cơ tim (đường kính <10nm) và vận chuyển mpx + bạch cầu trung tính được huy động sau chấn thương lạnh. Tuy nhiên, độ đào thải mpx + bạch cầu trung tính bị suy giảm, ở tim cá ngựa vằn không có mạch bạch huyết ở tim sau chấn thương lạnh. Một enzyme gọi là terminal deoxynucleotidyl transferase (TdT) sẽ sử dụng một loại nucleotide không chuỗi (dUTP) để đánh dấu các đoạn DNA đứt đầu, điều này thường xảy ra trong quá trình apoptosis khi DNA của tế bào bị phân hủy. Sau đó, các đoạn DNA đã được đánh dấu này có thể được tô màu bằng các phương pháp tô màu sinh hóa để quan sát và phân tích bằng kính hiển vi, cho phép xác định các tế bào đang trải qua apoptosis, điều này cho thấy sự tích tụ các tín hiệu dương tính với TUNEL tại vùng nhồi máu ở tim bị ảnh hưởng bởi mạch bạch huyết ở tim của cá ngựa vằn . Những kết quả này chỉ ra rằng chức năng của mạch bạch huyết tim trong việc giải phóng tế bào miễn dịch và loại bỏ tế bào hoại tử là rất cần thiết để tái tạo tim hiệu quả sau chấn thương lạnh ở cá ngựa vằn. Điều này cho thấy lợi ích điều trị trong việc nhắm vào các mạch bạch huyết ở tim của bệnh nhân sau nhồi máu cơ tim. Theo kết quả tái tạo tim của cá ngựa vằn, việc kích thích tạo mạch bạch huyết ở tim sau nhồi máu cơ tim có thể ngăn ngừa tình trạng viêm lâu dài và lắng đọng sẹo xơ. Sẽ rất thú vị khi nghiên cứu sâu hơn về sự rối loạn chuyển hóa cơ tim ở cá ngựa vằn thiếu bạch huyết tim và những ảnh hưởng tiềm tàng đối với sự tăng sinh và tái tạo cơ tim.
5.Hướng phát triển
Cá ngựa vằn là một mô hình mới nổi để nghiên cứu sự hình phát triển, tái sinh và mô phỏng bệnh tật ở người do nó dễ quan sát hình ảnh và sự sẵn có trong di truyền của chúng. Các nghiên cứu về mạch bạch huyết ở thân phôi cá ngựa vằn đã cung cấp những hiểu biết có giá trị về sự phát triển của bạch huyết. Các cơ quan khác nhau, bao gồm cả tim, có thể sử dụng các cơ chế đặc biệt của cơ quan/mô để điều chỉnh cân bằng nội môi chất lỏng và điều chế tế bào miễn dịch nhằm đáp ứng nhu cầu sinh lý của chúng và điều này hiện đang được nghiên cứu chuyên sâu. Đối với vai trò của mạch bạch huyết tim, các khía cạnh sau đây có thể được làm rõ và nghiên cứu thêm.
5.1. Sự hình thành và quần thể bạch huyết ở tim
Chúng tôi và những người khác đã thực hiện mô tả chi tiết về sự phát triển mạch bạch huyết của tim và quá trình tạo tế bào lympho mới trong quá trình tái tạo tim của cá ngựa vằn để làm cơ sở cho các nghiên cứu trong tương lai. Một khía cạnh bất ngờ của các mạch bạch huyết của tim ở cá ngựa vằn là tính chất không liên tục của chúng trên tâm thất. Một ống dẫn được hình thành như quan sát thấy sự hấp thu Qdot sau khi tiêm vào cơ tim, nhưng cũng có những nhóm tế bào nội mô bạch huyết riêng lẻ hoặc nhỏ thường được quan sát thấy có liên quan đến mạch bạch huyết chính của tim hoặc bị cô lập khỏi nó. Điều thú vị là Gancz và cộng sự phát hiện ra rằng quần thể này có độ nhạy khác nhau đối với những tác động khác nhau cho thấy rằng các tế bào biệt lập có thể không cần khung động mạch vành. Hơn nữa, các đường dẫn và nguồn tín hiệu bổ sung có thể định hướng sự phát triển bạch huyết của tim. Hiểu được sự phát triển của các mạch bạch huyết ở tim ở cấp độ tế bào và tín hiệu định hình chúng sẽ rất quan trọng để khuyến khích (hoặc ngăn cản) sự hình thành của chúng về mặt trị liệu.
Hiện vẫn chưa rõ liệu các tế bào và cụm bạch huyết biệt lập này có thực sự là một quần thể riêng biệt hay chúng là sản phẩm của quá trình hình thành mạch bạch huyết mỏng manh này. Chúng có thể phân ly và liên kết qua lại với mạch chính khi nó mở rộng trong quá trình phát triển và tái sinh. Điều này phù hợp với sự ghi nhận giảm được quan sát thấy của các tế bào nội mô bạch huyết bị cô lập đối với việc mất cxcr4a , biểu hiện dưới dạng một loạt mức độ nghiêm trọng về kiểu hình. Ở cá ngựa vằn đột biến cxcr4a phát triển một số mạch vành, điều này có thể đủ để hỗ trợ sự phát triển và mở rộng hạn chế của tế bào nội mô bạch huyết nhưng vẫn không đủ để hình thành mạch hoàn chỉnh. Điều đáng chú ý là các cụm tế bào nội mô bạch huyết biệt lập này được quan sát thoáng qua ở tim phôi chuột, nhưng nguồn gốc của các cụm được phát hiện là không thể phân biệt được với mạch chính. Điều này cho thấy, các cụm tế bào nội mô bạch huyết có thể được bắt nguồn từ mạch bạch huyết chính trong một quá trình, tương tự như quá trình phát triển phổi. Các cụm này tồn tại tạm thời trên chuột, không thể xác định được ở các giai đoạn sau. Khi sự phát triển của mạch tim tiến triển, các cụm này có thể dần dần hợp nhất với mạch chính.
Bất kể nguồn gốc, cũng có khả năng các quần thể tế bào nội mô bạch huyết bị cô lập có thể góp phần tái tạo tim. Chúng xuất hiện trong tim cá ngựa vằn trong quá trình tái tạo sau chấn thương lạnh. Hơn nữa, việc xác định loại bạch huyết đầu tiên RELN, gợi ý rằng những lợi ích tích cực sau nhồi máu cơ tim không chỉ giới hạn ở hệ bạch huyết hoạt động như một ống dẫn theo nghĩa cổ điển. Các tế bào riêng lẻ có thể bài tiết các yếu tố thúc đẩy tái tạo hoặc cung cấp các chức năng đào thải rác giống như chức năng được mô tả của tế bào nội mô bạch huyết não/tế bào biểu mô dạng hạt huỳnh quang. Sẽ rất thú vị khi khám phá thêm các chức năng hỗ trợ bất ngờ và các sự kiện hình thái của tế bào nội mô bạch huyết trong bối cảnh phát triển và tái tạo.
5.2. Đường truyền tín hiệu Điều chỉnh sự giãn nở của mạch bạch huyết ở tim
Nhiều con đường truyền tín hiệu khác nhau phát ra từ mạch vành hoặc cách khác có thể được khám phá thêm. Một con đường truyền tín hiệu ứng cử viên là Notch, được biết là có tác dụng điều chỉnh sự tăng sinh tế bào nội mô, sự vận động, sự hình thành nấm sợi, độ bám dính và ổn định mạch máu [ 84 ]. Các thụ thể và phối tử notch như Notch1 và DLL4 chủ yếu được biểu hiện ở các tế bào nội mô động mạch trong quá trình phát triển phôi và đặc điểm tế bào động mạch [ 85 , 86 ]. Kích hoạt Notch 1 bằng tế bào nội mô tĩnh mạch dương tính với DLL4 (VEC) đã được chứng minh là tạo ra cấu hình phiên mã bạch huyết và do đó, có thể cần phải kích hoạt phiên mã tín hiệu Notch để lập trình lại VEC thành tế bào nội mô bạch huyết [ 87 ]. Hơn nữa, mục tiêu di truyền của việc di chuyển tế bào nội mô bạch huyết bị suy yếu ở Notch trong quá trình phát triển phôi cá ngựa vằn [ 87 ] và ngăn chặn sự kích hoạt của nó bằng biểu hiện DLL4 dẫn đến điều hòa giảm Lyve1 và EphrinB2 cả in vitro [ 42 ] và in vivo [ 88 ]. Ngược lại, việc thiếu hoạt động Notch cũng dẫn đến sự nảy mầm bạch huyết tăng cường dẫn đến tăng sinh/sống sót tế bào nội mô bạch huyết ở chuột [ 89 , 90 ]. Vai trò của tín hiệu Notch trong tế bào nội mô bạch huyết tim ít được hiểu rõ hơn và sẽ cần nghiên cứu thêm.
5.3. Vai trò của bạch huyết tim trong nhồi máu cơ tim
Vai trò chính của mạch bạch huyết là làm sạch dịch kẽ. Mất mạch bạch huyết ở tim trên tâm thất dường như không làm phát sinh phù nề mô kẽ. Chỉ khi mất vegfd cùng với chức năng Vegfc bị tổn thương mới được quan sát thấy phì đại, nhưng không rõ liệu điều này có phải do phù nề kẽ hay không. Trong hầu hết các tình trạng tín hiệu Vegfc-Flt4 và/hoặc mạch vành bị tổn hại, các mạch bạch huyết BA hầu như không bị ảnh hưởng và điều này có thể đủ để cung cấp một ống dẫn để loại bỏ chất lỏng. Vẫn còn phải xác định xem liệu phì đại có được quan sát thấy trong dạng siêu hình vegfc hay không; đột biến kép vegfd ( vegfc hy−/− ; vegfd −/− ) là do giảm sút các tế bào BA, ], sự điều chỉnh không chính xác Flt4/Vegfr3 hoặc tác dụng của việc giảm sự tăng sinh tế bào cơ tim trước đó do mất các nguyên tố giảm thiểu như đã quan sát thấy ở con chuột Sự biến đổi kiểu hình được quan sát thấy ở vegfc hy−/− ; sự kết hợp vegfd −/− , thực tế là tất cả sự biến đổi trong kiểu hình được báo cáo qua ba nghiên cứu sử dụng các alen đột biến khác nhau, cần phải được xem xét dưới góc độ của các biến thể biến đổi khác nhau trong nền tảng di truyền.
Tổn thương mô tim xảy ra do phản ứng với nhồi máu cơ tim rất phức tạp, liên quan đến tình trạng thiếu oxy, hoại tử, viêm và xơ hóa. Mô hình chấn thương lạnh của tim cá ngựa vằn kết hợp những đặc điểm này mạnh mẽ hơn so với chấn thương cắt cụt chi. Sự phức tạp trong một mô hình có thể cản trở việc phân tích các quy trình cụ thể. Tuy nhiên, cái giá phải trả của sự đơn giản là không phải tất cả các đặc điểm của phản ứng tái tạo đều được ghi lại bằng mô hình cắt cụt chi. Trong phẫu thuật cắt cụt, thiếu sự hình thành mạch bạch huyết và phản ứng tái tạo không bị xáo trộn do mất bạch huyết trên tâm thất. Tuy nhiên, cả hai đều được quan sát thấy sau chấn thương lạnh. Việc so sánh các mô hình cho ta cái nhìn sâu sắc hơn về quá trình đang thúc đẩy sự phát triển của các mạch bạch huyết, vai trò của chúng tại vị trí vết thương và cách chúng có thể được sử dụng để giải quyết môi trường hậu nhồi máu cơ tim phức tạp được quan sát thấy ở bệnh nhân.
Các nguồn tham khảo của nghiên cứu:
1. Natale G., Bocci G., Ribatti D. Scholars and scientists in the history of the lymphatic system. J. Anat. 2017;231:417–429. [PMC free article] [PubMed] [Google Scholar]
2. Oliver G., Kipnis J., Randolph G.J., Harvey N.L. The Lymphatic Vasculature in the 21st Century: Novel Functional Roles in Homeostasis and Disease. Cell. 2020;182:270–296. [PMC free article] [PubMed] [Google Scholar]
3. Brouillard P., Boon L., Vikkula M. Genetics of lymphatic anomalies. J. Clin. Investig. 2014;124:898–904. [PMC free article] [PubMed] [Google Scholar]
4. Rockson S.G. Lymphedema. Am. J. Med. 2001;110:288–295. [PubMed] [Google Scholar]
5. Randolph G.J., Ivanov S., Zinselmeyer B.H., Scallan J.P. The lymphatic system: Integral roles in immunity. Annu. Rev. Immunol. 2017;35:31–52. [PMC free article] [PubMed] [Google Scholar]
6. Bogoslowski A., Butcher E.C., Kubes P. Neutrophils recruited through high endothelial venules of the lymph nodes via PNAd intercept disseminating Staphylococcus aureus. Proc. Natl. Acad. Sci. USA. 2018;115:2449–2454. doi: 10.1073/pnas.1715756115. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7. Takeda A., Hollmén M., Dermadi D., Pan J., Brulois K.F., Kaukonen R., Lönnberg T., Boström P., Koskivuo I., Irjala H., et al. Single-Cell Survey of Human Lymphatics Unveils Marked Endothelial Cell Heterogeneity and Mechanisms of Homing for Neutrophils. Immunity. 2019;51:561–572. doi: 10.1016/j.immuni.2019.06.027. [PubMed] [CrossRef] [Google Scholar]
8. Bernier-Latmani J., Petrova T. V Intestinal lymphatic vasculature: Structure, mechanisms and functions. Nat. Publ. Gr. 2017;14 doi: 10.1038/nrgastro.2017.79. [PubMed] [CrossRef] [Google Scholar]
9. Harvey N.L., Srinivasan R.S., Dillard M.E., Johnson N.C., Witte M.H., Boyd K., Sleeman M.W., Oliver G. Lymphatic vascular defects promoted by Prox1 haploinsufficiency cause adult-onset obesity. Nat. Genet. 2005;37:1072–1081. doi: 10.1038/ng1642. [PubMed] [CrossRef] [Google Scholar]
10. Escobedo N., Proulx S., Karaman S., Dillard M.E., Johnson N., Detmar M., Oliver G. undefined Restoration of lymphatic function rescues obesity in Prox1-haploinsufficient mice. JCI Insight. 2016;1:85096. doi: 10.1172/jci.insight.85096. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
11. Kampmeier O.F. Evolution and Comparative Morphology of the Lymphatic System. Vol. 64. Charles C Thomas; Springfield, IL, USA: 1971. [Google Scholar]
12. Romer A.S. The Vertebrate Body. W.B. Saunders; Philadelphia, PA, USA: 1977. [Google Scholar]
13. Peyrot S.M., Martin B.L., Harland R.M. Lymph heart musculature is under distinct developmental control from lymphatic endothelium. Dev. Biol. 2010;339:429–438. doi: 10.1016/j.ydbio.2010.01.002. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
14. Steffensen J.F., Lomholt J.P. Fish Physiology. Vol. 12. Academic Press; Cambridge, MA, USA: 1992. The secondary vascular system; pp. 185–217. [Google Scholar]
15. Küchler A.M., Gjini E., Peterson-Maduro J., Cancilla B., Wolburg H., Schulte-Merker S. Development of the Zebrafish Lymphatic System Requires Vegfc Signaling. Curr. Biol. 2006;16:1244–1248. doi: 10.1016/j.cub.2006.05.026. [PubMed] [CrossRef] [Google Scholar]
16. Yaniv K., Isogai S., Castranova D., Dye L., Hitomi J., Weinstein B.M. Live imaging of lymphatic development in the zebrafish. Nat. Med. 2006;12:711–716. doi: 10.1038/nm1427. [PubMed] [CrossRef] [Google Scholar]
17. Shin M., Nozaki T., Idrizi F., Isogai S., Ogasawara K., Ishida K., Yuge S., Roscoe B., Wolfe S.A., Fukuhara S., et al. Valves Are a Conserved Feature of the Zebrafish Lymphatic System. Dev. Cell. 2019;51:374–386. doi: 10.1016/j.devcel.2019.08.019. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
18. Vogel W.O.P., Claviez M. Vascular Specialization in Fish, but No Evidence for Lymphatics. Z. Naturforsch. C J. Biosci. 1981;36:490–492. [Google Scholar]
19. Vogel W.O.P. Zebrafish and lymphangiogenesis: A reply. Anat. Sci. Int. 2010;85:118–119. [PubMed] [Google Scholar]
20. Jensen L.D.E., Cao R., Hedlund E.M., Söll I., Lundberg J.O., Hauptmann G., Steffensen J.F., Cao Y. Nitric oxide permits hypoxia-induced lymphatic perfusion by controlling arterial-lymphatic conduits in zebrafish and glass catfish. Proc. Natl. Acad. Sci. USA. 2009;106:18408–18413. doi: 10.1073/pnas.0907608106. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Isogai S., Hitomi J., Yaniv K., Weinstein B.M. Zebrafish as a new animal model to study lymphangiogenesis. Anat. Sci. Int. 2009;84:102–111. [PubMed] [Google Scholar]
22. Koltowska K., Lagendijk A.K., Pichol-Thievend C., Fischer J.C., Francois M., Ober E.A., Yap A.S., Hogan B.M. Vegfc Regulates Bipotential Precursor Division and Prox1 Expression to Promote Lymphatic Identity in Zebrafish. Cell Rep. 2015;13:1828–1841. doi: 10.1016/j.celrep.2015.10.055. [PubMed] [CrossRef] [Google Scholar]
23. Shin M., Male I., Beane T.J., Villefranc J.A., Kok F.O., Zhu L.J., Lawson N.D. Vegfc acts through ERK to induce sprouting and differentiation of trunk lymphatic progenitors. Development. 2016;143:3785–3795. doi: 10.1242/dev.137901. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
24. Nicenboim J., Malkinson G., Lupo T., Asaf L., Sela Y., Mayseless O., Gibbs-Bar L., Senderovich N., Hashimshony T., Shin M., et al. Lymphatic vessels arise from specialized angioblasts within a venous niche. Nature. 2015;522:56–61. doi: 10.1038/nature14425. [PubMed] [CrossRef] [Google Scholar]
25. Jung H.M., Castranova D., Swift M.R., Pham V.N., Venero Galanternik M., Isogai S., Butler M.G., Mulligan T.S., Weinstein B.M. Development of the larval lymphatic system in zebrafish. Development. 2017;144:2070–2081. doi: 10.1242/dev.145755. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
26. Okuda K.S., Astin J.W., Misa J.P., Flores M.V., Crosier K.E., Crosier P.S. lyve1 expression reveals novel lymphatic vessels and new mechanisms for lymphatic vessel development in zebrafish. Development. 2012;139:2381–2391. doi: 10.1242/dev.077701. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
27. Coffindaffer-Wilson M., Craig M.P., Hove J.R. Determination of lymphatic vascular identity and developmental timecourse in zebrafish (Danio rerio) Lymphology. 2011;44:1–12. [PubMed] [Google Scholar]
28. Venero Galanternik M., Stratman A.N., Jung H.M., Butler M.G., Weinstein B.M. Building the drains: The lymphatic vasculature in health and disease. Wiley Interdiscip. Rev. Dev. Biol. 2016;5:689–710. [PubMed] [Google Scholar]
29. Sabin F.R. On the origin of the lymphatic system from the veins and the development of the lymph hearts and thoracic duct in the pig. Am. J. Anat. 1902;1:367–389. doi: 10.1002/aja.1000010310. [CrossRef] [Google Scholar]
30. Wilting J., Aref Y., Huang R., Tomarev S.I., Schweigerer L., Christ B., Valasek P., Papoutsi M. Dual origin of avian lymphatics. Dev. Biol. 2006;292:165–173. doi: 10.1016/j.ydbio.2005.12.043. [PubMed] [CrossRef] [Google Scholar]
31. Kampmeier O.F. On the lymph flow of the human heart, with reference to the development of the channels and the first appearance, distribution, and physiology of their valves. Am. Heart J. 1928;4:210–222. doi: 10.1016/S0002-8703(28)90071-X. [CrossRef] [Google Scholar]
32. Klotz L., Norman S., Vieira J.M., Masters M., Rohling M., Dube K.N., Bollini S., Matsuzaki F., Carr C.A., Riley P.R. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 2015;522:62–67. doi: 10.1038/nature14483. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
33. Harrison M.R., Feng X., Mo G., Aguayo A., Villafuerte J., Yoshida T., Pearson C.A., Schulte-Merker S., Ching-Ling L. Late developing cardiac lymphatic vasculature supports adult zebrafish heart function and regeneration. eLife. 2019;8 doi: 10.7554/eLife.42762. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
34. Gancz D., Raftrey B.C., Perlmoter G., Marín-Juez R., Semo J., Matsuoka R.L., Karra R., Raviv H., Moshe N., Addadi Y., et al. Distinct origins and molecular mechanisms contribute to lymphatic formation during cardiac growth and regeneration. eLife. 2019;8 doi: 10.7554/eLife.44153. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
35. Ratajska A., Gula G., Flaht-Zabost A., Czarnowska E., Ciszek B., Jankowska-Steifer E., Niderla-Bielinska J., Radomska-Lesniewska D. Comparative and Developmental Anatomy of Cardiac Lymphatics. Sci. World J. 2014 doi: 10.1155/2014/183170. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
36. Srinivasan R.S., Dillard M.E., Lagutin O.V., Lin F.J., Tsai S., Tsai M.J., Samokhvalov I.M., Oliver G. Lineage tracing demonstrates the venous origin of the mammalian lymphatic vasculature. Genes Dev. 2007;21:2422–2432. doi: 10.1101/gad.1588407. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
37. Martinez-Corral I., Ulvmar M.H., Stanczuk L., Tatin F., Kizhatil K., John S.W.M., Alitalo K., Ortega S., Makinen T. Nonvenous origin of dermal lymphatic vasculature. Circ. Res. 2015;116:1649–1654. doi: 10.1161/CIRCRESAHA.116.306170. [PubMed] [CrossRef] [Google Scholar]
38. Stanczuk L., Martinez-Corral I., Ulvmar M.H., Zhang Y., Laviña B., Fruttiger M., Adams R.H., Saur D., Betsholtz C., Ortega S., et al. CKit lineage hemogenic endothelium-derived cells contribute to mesenteric lymphatic vessels. Cell Rep. 2015;10:1708–1721. doi: 10.1016/j.celrep.2015.02.026. [PubMed] [CrossRef] [Google Scholar]
39. Lioux G., Liu X., Temiño S., Oxendine M., Ayala E., Ortega S., Kelly R.G., Oliver G., Torres M. A Second Heart Field-Derived Vasculogenic Niche Contributes to Cardiac Lymphatics. Dev. Cell. 2020;52:350–363. doi: 10.1016/j.devcel.2019.12.006. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
40. Maruyama K., Miyagawa-Tomita S., Mizukami K., Matsuzaki F., Kurihara H. Isl1-expressing non-venous cell lineage contributes to cardiac lymphatic vessel development. Dev. Biol. 2019;452:134–143. doi: 10.1016/j.ydbio.2019.05.002. [PubMed] [CrossRef] [Google Scholar]
41. Eng T.C., Chen W., Okuda K.S., Misa J.P., Padberg Y., Crosier K.E., Crosier P.S., Hall C.J., Schulte-Merker S., Hogan B.M., et al. Zebrafish facial lymphatics develop through sequential addition of venous and non-venous progenitors. EMBO Rep. 2019;20 doi: 10.15252/embr.201847079. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
42. Kang J., Yoo J., Lee S., Tang W., Aguilar B., Ramu S., Choi I., Otu H.H., Shin J.W., Dotto G.P., et al. An exquisite cross-control mechanism among endothelial cell fate regulators directs the plasticity and heterogeneity of lymphatic endothelial cells. Blood. 2010;116:140–150. doi: 10.1182/blood-2009-11-252270. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
43. You L.R., Lin F.J., Lee C.T., DeMayo F.J., Tsai M.J., Tsai S.Y. Suppression of Notch signalling by the COUP-TFII transcription factor regulates vein identity. Nature. 2005;435:98–104. doi: 10.1038/nature03511. [PubMed] [CrossRef] [Google Scholar]
44. Johnson N.C., Dillard M.E., Baluk P., McDonald D.M., Harvey N.L., Frase S.L., Oliver G. Lymphatic endothelial cell identity is reversible and its maintenance requires Prox1 activity. Genes Dev. 2008;22:3282–3291. [PMC free article] [PubMed] [Google Scholar]
45. Wigle J.T., Harvey N., Detmar M., Lagutina I., Grosveld G., Gunn M.D., Jackson D.G., Oliver G. An essential role for Prox1 in the induction of the lymphatic endothelial cell phenotype. EMBO J. 2002;21:1505–1513. [PMC free article] [PubMed] [Google Scholar]
46. François M., Caprini A., Hosking B., Orsenigo F., Wilhelm D., Browne C., Paavonen K., Karnezis T., Shayan R., Downes M., et al. Sox18 induces development of the lymphatic vasculature in mice. Nature. 2008;456:643–647. [PubMed] [Google Scholar]
47. Srinivasan R.S., Geng X., Yang Y., Wang Y., Mukatira S., Studer M., Porto M.P.R., Lagutin O., Oliver G. The nuclear hormone receptor Coup-TFII is required for the initiation and early maintenance of Prox1 expression in lymphatic endothelial cells. Genes Dev. 2010;24:696–707. [PMC free article] [PubMed] [Google Scholar]
48. Kazenwadel J., Secker G.A., Liu Y.J., Rosenfeld J.A., Wildin R.S., Cuellar-Rodriguez J., Hsu A.P., Dyack S., Fernandez C.V., Chong C.E., et al. Loss-of-function germline GATA2 mutations in patients with MDS/AML or MonoMAC syndrome and primary lymphedema reveal a key role for GATA2 in the lymphatic vasculature. Blood. 2012;119:1283–1291. [PMC free article] [PubMed] [Google Scholar]
49. Kazenwadel J., Betterman K.L., Chong C.E., Stokes P.H., Lee Y.K., Secker G.A., Agalarov Y., Demir C.S., Lawrence D.M., Sutton D.L., et al. GATA2 is required for lymphatic vessel valve development and maintenance. J. Clin. Investig. 2015;125:2879–2994. [PMC free article] [PubMed] [Google Scholar]
50. Gauvrit S., Villasenor A., Strilic B., Kitchen P., Collins M.M., Marín-Juez R., Guenther S., Maischein H.M., Fukuda N., Canham M.A., et al. HHEX is a transcriptional regulator of the VEGFC/FLT4/PROX1 signaling axis during vascular development. Nat. Commun. 2018;9:1–4. [PMC free article] [PubMed] [Google Scholar]
51. Karkkainen M.J., Haiko P., Sainio K., Partanen J., Taipale J., Petrova T.V., Jeltsch M., Jackson D.G., Talikka M., Rauvala H., et al. Vascular endothelial growth factor C is required for sprouting of the first lymphatic vessels from embryonic veins. Nat. Immunol. 2004;5:74–80. doi: 10.1038/ni1013. [PubMed] [CrossRef] [Google Scholar]
52. Xu Y., Yuan L., Mak J., Pardanaud L., Caunt M., Kasman I., Larrivée B., Del Toro R., Suchting S., Medvinsky A., et al. Neuropilin-2 mediates VEGF-C-induced lymphatic sprouting together with VEGFR3. J. Cell Biol. 2010;188:115–130. [PMC free article] [PubMed] [Google Scholar]
53. Wirzenius M., Tammela T., Uutela M., He Y., Odorisio T., Zambruno G., Nagy J.A., Dvorak H.F., Ylä-Herttuala S., Shibuya M., et al. Distinct vascular endothelial growth factor signals for lymphatic vessel enlargement and sprouting. J. Exp. Med. 2007;204:1431–1440. [PMC free article] [PubMed] [Google Scholar]
54. Veikkola T., Jussila L., Makinen T., Karpanen T., Jeltsch M., Petrova T.V., Kubo H., Thurston G., McDonald D.M., Achen M.G., et al. Signalling via vascular endothelial growth factor receptor-3 is sufficient for lymphangiogenesis in transgenic mice. EMBO J. 2001;20:1223–1231. [PMC free article] [PubMed] [Google Scholar]
55. He Y., Rajantie I., Pajusola K., Jeltsch M., Holopainen T., Yla-Herttuala S., Harding T., Jooss K., Takahashi T., Alitalo K. Vascular endothelial cell growth factor receptor 3-mediated activation of lymphatic endothelium is crucial for tumor cell entry and spread via lymphatic vessels. Cancer Res. 2005;65:4739–4746. [PubMed] [Google Scholar]
56. Jurisic G., Detmar M. Lymphatic endothelium in health and disease. Cell Tissue Res. 2009;335:97–108. [PubMed] [Google Scholar]
57. Maby-El Hajjami H., Petrova T.V. Developmental and pathological lymphangiogenesis: From models to human disease. Histochem. Cell Biol. 2008;130:1063–1078. [PubMed] [Google Scholar]
58. Hogan B.M., Herpers R., Witte M., Heloterä H., Alitalo K., Duckers H.J., Schulte-Merker S. Vegfc/Flt4 signalling is suppressed by Dll4 in developing zebrafish intersegmental arteries. Development. 2009;136:4001–4009. [PubMed] [Google Scholar]
59. van Impel A., Zhao Z., Hermkens D.M.A., Roukens M.G., Fischer J.C., Peterson-Maduro J., Duckers H., Ober E.A., Ingham P.W., Schulte-Merker S. Divergence of zebrafish and mouse lymphatic cell fate specification pathways. Development. 2014;141:1228–1238. [PMC free article] [PubMed] [Google Scholar]
60. Vivien C.J., Pichol-Thievend C., Sim C.B., Smith J.B., Bower N.I., Hogan B.M., Hudson J.E., Francois M., Porrello E.R. Vegfc/d-dependent regulation of the lymphatic vasculature during cardiac regeneration is influenced by injury context. NPJ Regen. Med. 2019;4:18. [PMC free article] [PubMed] [Google Scholar]
61. Guerrero A., Icardo J.M., Durán A.C., Gallego A., Domezain A., Colvee E., Sans-Coma V. Differentiation of the cardiac outflow tract components in alevins of the sturgeon Acipenser naccarii (Osteichthyes, Acipenseriformes): Implications for heart evolution. J. Morphol. 2004;260:172–183. [PubMed] [Google Scholar]
62. Harvey N.L. The link between lymphatic function and adipose biology. Ann. N. Y. Acad. Sci. 2008;1131:82–88. [PubMed] [Google Scholar]
63. Lim H.Y., Thiam C.H., Yeo K.P., Bisoendial R., Hii C.S., McGrath K.C.Y., Tan K.W., Heather A., Alexander J.S.J., Angeli V. Lymphatic vessels are essential for the removal of cholesterol from peripheral tissues by SR-BI-Mediated transport of HDL. Cell Metab. 2013;17:671–684. [PubMed] [Google Scholar]
64. Gomez D., Shankman L.S., Nguyen A.T., Owens G.K. Detection of histone modifications at specific gene loci in single cells in histological sections. Nat. Methods. 2013;10:171–177. [PMC free article] [PubMed] [Google Scholar]
65. Hansson G.K., Nilsson J. Vaccination against atherosclerosis? Induction of atheroprotective immunity. Semin. Immunopathol. 2009;31:95–101. [PubMed] [Google Scholar]
66. Kannel W.B., Dawber T.R., Kagan A., Revotskie N., Stokes J. Factors of risk in the development of coronary heart disease–six year follow-up experience. The Framingham Study. Ann. Intern. Med. 1961;55:33–50. doi: 10.7326/0003-4819-55-1-33. [PubMed] [CrossRef] [Google Scholar]
67. Kholová I., Dragneva G., Čermáková P., Laidinen S., Kaskenpää N., Hazes T., Čermáková E., Šteiner I., Ylä-Herttuala S. Lymphatic vasculature is increased in heart valves, ischaemic and inflamed hearts and in cholesterol-rich and calcified atherosclerotic lesions. Eur. J. Clin. Investig. 2011;41:487–497. [PubMed] [Google Scholar]
68. Nykanen A.I., Sandelin H., Krebs R., Keranen M.A.I., Tuuminen R., Karpanen T., Wu Y., Pytowski B., Koskinen P.K., Yla-Herttuala S., et al. Targeting Lymphatic Vessel Activation and CCL21 Production by Vascular Endothelial Growth Factor Receptor-3 Inhibition Has Novel Immunomodulatory and Antiarteriosclerotic Effects in Cardiac Allografts. Circulation. 2010;121:1413–1422. [PubMed] [Google Scholar]
69. Thygesen K., Alpert J.S., Jaffe A.S., Simoons M.L., Chaitman B.R., White H.D. Third universal definition of myocardial infarction. Nat. Rev. Cardiol. 2012;9:620–633. [PubMed] [Google Scholar]
70. Henri O., Pouehe C., Houssari M., Galas L., Nicol L., Edwards-Levy F., Henry J.P., Dumesnil A., Boukhalfa I., Banquet S., et al. Selective Stimulation of Cardiac Lymphangiogenesis Reduces Myocardial Edema and Fibrosis Leading to Improved Cardiac Function Following Myocardial Infarction. Circulation. 2016;133:1484–1497. [PubMed] [Google Scholar]
71. Ishikawa Y., Akishima-Fukasawa Y., Ito K., Akasaka Y., Tanaka M., Shimokawa R., Kimura-Matsumoto M., Morita H., Sato S., Kamata I., et al. Lymphangiogenesis in myocardial remodelling after infarction. Histopathology. 2007;51:345–353. [PMC free article] [PubMed] [Google Scholar]
72. Vuorio T., Ylä-Herttuala E., Laakkonen J.P., Laidinen S., Liimatainen T., Ylä-Herttuala S. Downregulation of VEGFR3 signaling alters cardiac lymphatic vessel organization and leads to a higher mortality after acute myocardial infarction. Sci. Rep. 2018;8:1–13. [PMC free article] [PubMed] [Google Scholar]
73. Tatin F., Renaud-Gabardos E., Godet A.C., Hantelys F., Pujol F., Morfoisse F., Calise D., Viars F., Valet P., Masri B., et al. Apelin modulates pathological remodeling of lymphatic endothelium after myocardial infarction. JCI Insight. 2017;2 doi: 10.1172/jci.insight.93887. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
74. Vieira J.M., Norman S., del, Campo C.V., Cahill T.J., Barnette D.N., Gunadasa-Rohling M., Johnson L.A., Greaves D.R., Carr C.A., Jackson D.G., et al. The cardiac lymphatic system stimulates resolution of inflammation following myocardial infarction. J. Clin. Investig. 2018;128 doi: 10.1172/JCI97192. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
75. Sawane M., Kajiya K., Kidoya H., Takagi M., Muramatsu F., Takakura N. Apelin inhibits diet-induced obesity by enhancing lymphatic and blood vessel integrity. Diabetes. 2013;62:1970–1980. [PMC free article] [PubMed] [Google Scholar]
76. Gale N.W., Prevo R., Espinosa J., Ferguson D.J., Dominguez M.G., Yancopoulos G.D., Thurston G., Jackson D.G. Normal Lymphatic Development and Function in Mice Deficient for the Lymphatic Hyaluronan Receptor LYVE-1. Mol. Cell. Biol. 2007;27:595–604. [PMC free article] [PubMed] [Google Scholar]
77. Johnson L.A., Banerji S., Lawrance W., Gileadi U., Prota G., Holder K.A., Roshorm Y.M., Hanke T., Cerundolo V., Gale N.W., et al. Dendritic cells enter lymph vessels by hyaluronan-mediated docking to the endothelial receptor LYVE-1. Nat. Immunol. 2017;18:762–770. [PubMed] [Google Scholar]
78. Liu X., De la Cruz E., Gu X., Balint L., Oxendine-Burns M., Terrones T., Ma W., Kuo H.H., Lantz C., Bansal T., et al. Lymphoangiocrine signals promote cardiac growth and repair. Nature. 2020;588:705–711. [PMC free article] [PubMed] [Google Scholar]
79. González-Rosa J.M., Burns C.E., Burns C.G. Zebrafish heart regeneration: 15 years of discoveries. Regeneration. 2017;4:105–123. [PMC free article] [PubMed] [Google Scholar]
80. Harrison M.R.M., Bussmann J., Huang Y., Zhao L., Osorio A., Burns C.G., Burns G.E., Sucov H.M., Siekmann A.F., Lien C.L. Chemokine-guided angiogenesis directs coronary vasculature formation in zebrafish. Dev. Cell. 2015;33:442–454. [PMC free article] [PubMed] [Google Scholar]
81. Kulkarni R.M., Herman A., Ikegami M., Greenberg J.M., Akeson A.L. Lymphatic ontogeny and effect of hypoplasia in developing lung. Mech. Dev. 2011;128:29–40. [PubMed] [Google Scholar]
82. Galanternik M.V., Castranova D., Gore A.V., Blewett N.H., Jung H.M., Stratman A.N., Kirby M.R., Iben J., Miller M.F., Kawakami K., et al. A novel perivascular cell population in the zebrafish brain. eLife. 2017;6 doi: 10.7554/eLife.24369. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
83. van Lessen M., Shibata-Germanos S., van Impel A., Hawkins T.A., Rihel J., Schulte-Merker S. Intracellular uptake of macromolecules by brain lymphatic endothelial cells during zebrafish embryonic development. eLife. 2017;6 doi: 10.7554/eLife.25932. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
84. Phng L.K., Gerhardt H. Angiogenesis: A Team Effort Coordinated by Notch. Dev. Cell. 2009;16:196–208. [PubMed] [Google Scholar]
85. Kume T. Novel insights into the differential functions of Notch ligands in vascular formation. J. Angiogenes. Res. 2009;1:8. doi: 10.1186/2040-2384-1-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
86. Gridley T. Notch signaling in the vasculature. Curr. Top Dev. Biol. 2010;92:277–309. [PMC free article] [PubMed] [Google Scholar]
87. Geudens I., Herpers R., Hermans K., Segura I., Ruiz de Almodovar C., Bussmann J., De Smet F., Vandevelde W., Hogan B.M., Siekmann A., et al. Role of delta-like-4/Notch in the formation and wiring of the lymphatic network in zebrafish. Arter. Thromb. Vasc. Biol. 2010;30:1695–1702. [PMC free article] [PubMed] [Google Scholar]
88. Niessen K., Zhang G., Ridgway J.B., Chen H., Kolumam G., Siebel C.W., Yan M. The notch1-Dll4 signaling pathway regulates mouse postnatal lymphatic development. Blood. 2011;118:1989–1997. [PubMed] [Google Scholar]
89. Zheng W., Tammela T., Yamamoto M., Anisimov A., Holopainen T., Kaijalainen S., Karpanen T., Lehti K., Ylä-Herttuala S., Alitalo K. Notch restricts lymphatic vessel sprouting induced by vascular endothelial growth factor. Blood. 2011;118:1154–1162. [PubMed] [Google Scholar]
90. Fatima A., Culver A., Culver F., Liu T., Dietz W.H., Thomson B.R., Hadjantonakis A.K., Quaggin S.E., Kume T. Murine Notch1 is required for lymphatic vascular morphogenesis during development. Dev. Dyn. 2014;243:957–964. [PMC free article] [PubMed] [Google Scholar]
91. Crim M.J., Lawrence C. A fish is not a mouse: Understanding differences in background genetics is critical for reproducibility. Lab Anim. 2021;50:19–25. [PubMed] [Google Scholar]
Các bài viết liên quan
Thomas Bartholin và hệ bạch huyết
Hiệu quả của việc dẫn lưu bạch huyết bằng tay trong điều trị tích cực giai đoạn I của bệnh phù bạch huyết liên quan đến ung thư vú
Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
Danh mục sản phẩm
-
Hotline mua hàng 096.7786.399
-
Giao hàng miễn phí Đơn hàng >1tr
-
Sản phẩm chính hãng Cam kết chính hãng 100%