Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 4: Sự hình thành mạng lưới van, mạch bạch huyết
- Phát triển mạng lưới mạch bạch huyết
- Sự hình thành bạch huyết và mối quan hệ với sự hình thành mạch trong quá trình tu sửa mạng lưới vi mạch
- Dòng chảy kẽ và sự hình thành bạch huyết
- Xuất bản: trực tuyến năm 2018 ngày 13 tháng 12
- Tác giả: Jerome W. Breslin , 1 Ying Yang , 1 Joshua P. Scallan , 1 Richard S. Sweat , 2 Shaquria P. Adderley , 1 và W. Lee Murfee 3
- Link nghiên cứu: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6459625/
Xem lại PHẦN 3 của nghiên cứu này.
Những suy nghĩ kết luận về cấu trúc mạng bạch huyết
Nội dung chính [hiện]
Trong cuộc thảo luận của chúng ta về các cơ quan khác nhau thực hiện nhiều chức năng khác nhau của cơ thể, có những điểm tương đồng trong mạng lưới bạch huyết. Mặc dù có nhiều biến thể trong cấu trúc mạng lưới, nhưng nhìn chung có một mạng lưới bạch huyết ban đầu (mạng lưới mao mạch bạch huyết) đóng vai trò là cửa ngõ cho sự hấp thu dịch kẽ. Mạng lưới bạch huyết thường nằm gần với hệ thống vi mạch cục bộ và thường đi theo mạng lưới động mạch/tiểu mạch. Trong nhiều trường hợp, có các bộ phận thu gom trước có van một chiều trong mô, trong khi hệ bạch huyết thu thập có thể nằm trong một cơ quan hoặc tại các điểm thoát ra của cơ quan đó. Một số cơ quan như mạc treo có nhiều hoạt động bơm để thu thập bạch huyết, trong khi các cơ quan thường xuyên co bóp (tim) hoặc bị căng phồng (phổi) dường như yêu cầu bơm ít nội tại hơn để thu thập bạch huyết. Một số cơ quan, như não và mắt, có tương đối ít bạch huyết, trong khi những cơ quan khác, như tuyến nội tiết, có mạng lưới bạch huyết rộng khắp. Bất chấp sự khác biệt về cấu trúc mạng lưới của từng cơ quan, cơ sở hạ tầng của mạch bạch huyết và các dấu hiệu protein xác định nội mô bạch huyết là tương tự nhau đáng kể giữa các cơ quan khác nhau được nghiên cứu.
- Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
- Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
- Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
- Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
- Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Phát triển mạng lưới mạch bạch huyết
Sự hình thành mạch bạch huyết bao gồm bốn khía cạnh quan trọng: nguồn gốc của các tế bào nội mô bạch huyết (LEC), đặc điểm kỹ thuật và sự di chuyển của LEC, sự trưởng thành của mạch bạch huyết và tuyển dụng tế bào cơ trơn (SMC) và sự hình thành van bạch huyết. Ở đây chúng tôi đề cập đến các chủ đề này và thảo luận về những tiến bộ mới nhất trong nghiên cứu phát triển mạch bạch huyết.
Nguồn gốc của LEC
Không giống như mạch máu, mạch bạch huyết là một mạch máu trong mờ trong cơ thể, điều này cho đến gần đây khiến việc nghiên cứu nó tương đối khó khăn. Nghiên cứu tìm ra nguồn gốc của sự phát triển mạch bạch huyết được bắt đầu từ thế kỷ 17. Vào đầu thế kỷ 20, Florence Sabin lần đầu tiên đề xuất rằng mạch bạch huyết phát sinh từ các tĩnh mạch chính (CV) từ nghiên cứu của bà về phôi lợn (943). Mãi về sau, khi yếu tố phiên mã Prox1 được xác định là yếu tố điều hòa chính cho sự phát triển mạch bạch huyết ( 1140 ), việc truy tìm dòng dõi bằng chuột phóng viên Prox1 đã tiết lộ rằng thực sự các tế bào nội mô tĩnh mạch trong tĩnh mạch chính đã tạo ra LEC ( 1011 ). Kết quả tương tự cũng được thấy ở phôi cá ngựa vằn sử dụng kỹ thuật hình ảnh sống ( 1170 ).
Điều đáng chú ý là sự hình thành mạch bạch huyết của chuột diễn ra rất nhanh trong quá trình phát triển. Từ ngày phôi thai (E) 9.5, khi đặc điểm của tổ tiên Prox1 + LEC lần đầu tiên xuất hiện trong CV, đến E14.5 khi toàn bộ da của phôi chuột được bao phủ bởi mạch bạch huyết, đặc điểm, sự tăng sinh và di cư của hàng triệu LEC cần diễn ra trong một khoảng thời gian ngắn (Hình 23A). Điều này đặt ra câu hỏi liệu CV có phải là nguồn duy nhất cho các tổ tiên của LEC hay không. Trong 5 năm qua, câu hỏi này đã được nghiên cứu theo nhiều cách khác nhau. Đầu tiên, các tĩnh mạch xen kẽ (ISV) và đám rối tĩnh mạch bề mặt được xác định là nguồn bổ sung của các chất tiền thân LEC trong phôi chuột. Tiền thân Prox1 + LEC được chỉ định không chỉ trong CV mà còn trong ISV và đám rối tĩnh mạch nông ( 403 , 1168 ). Những phát hiện này phù hợp với những quan sát trước đây rằng tổ tiên của LEC có nguồn gốc từ tĩnh mạch. Quan trọng hơn, các nghiên cứu khác đã phát hiện ra nguồn gốc không phải từ tĩnh mạch ở một số bộ phận của mạch bạch huyết. Ví dụ, các nguyên bào mạch chuyên biệt có thể biệt hóa thành LEC trong CV ở phôi cá ngựa vằn ( 765 ). Mặc dù George Huntington và Charles McClure đã đề xuất nguồn gốc không phải từ tĩnh mạch của ít nhất một số LEC vào năm 1910 ( 454 ), nhưng đây là lần đầu tiên các tế bào trung mô được chứng minh là góp phần vào sự hình thành mạch bạch huyết trong quá trình phát triển phôi thai ( 765 ). Trong khi đó, ở hệ mạch bạch huyết ở da chuột, trong khi mạch bạch huyết của da cổ và da ngực vẫn có nguồn gốc từ các tĩnh mạch, thì các mạch bạch huyết của da vùng thắt lưng và vùng lưng được phát hiện là hình thành từ các tổ tiên có nguồn gốc không phải từ tĩnh mạch (Hình 23B) ( 657 ).

Sơ đồ về sự phát triển ban đầu của mạch bạch huyết ở động vật có vú và nguồn gốc khác nhau của các mạch bạch huyết ở cơ quan cụ thể. MỘT . Hình ảnh dọc của các bước quan trọng trong quá trình hình thành cấu trúc bạch huyết đầu tiên – túi bạch huyết dọc theo tĩnh mạch chính (CV) từ E9.0 đến E11.5 trong phôi chuột. Xung quanh E9.5, các yếu tố phiên mã CoupTFII và Sox18 tạo ra biểu hiện Prox1 trong một quần thể EC tĩnh mạch trong CV và các mạch kẽ (ISV). Sự xuất hiện của các tổ tiên LEC biểu hiện Prox1 cho thấy đặc điểm kỹ thuật LEC đã bắt đầu. Hầu hết những tổ tiên đó bắt đầu rời khỏi CV và ISV và di chuyển vào trung mô xung quanh để đáp ứng với gradient VEGFC. Các LEC khác biệt duy trì biểu hiện của Vegfr3 qua trung gian Prox1. Khi LEC di chuyển và sinh sôi nảy nở theo cách liên kết với nhau, chúng tập hợp lại với nhau để tạo thành các túi bạch huyết xung quanh E11.5. B. Cả LEC có nguồn gốc từ tĩnh mạch (màu xanh lá cây) và LEC không có nguồn gốc từ tĩnh mạch (màu xanh nhạt) đều góp phần hình thành mạch bạch huyết ở lớp hạ bì, tim và mạc treo trong khi các túi bạch huyết chỉ được hình thành bởi LEC có nguồn gốc từ tĩnh mạch . C . Khi LEC sinh sôi nảy nở và nảy mầm ra khỏi túi bạch huyết, chúng bắt đầu tái cấu trúc thành các mạch bạch huyết thu thập và các mao mạch bạch huyết xung quanh E14.5. Trong quá trình trưởng thành của mạng lưới mạch bạch huyết, các mạch bạch huyết thu thập hình thành các van trong lòng mạch để ngăn chặn dòng bạch huyết chảy ngược và huy động các tế bào cơ trơn ra bên ngoài mạch để tạo điều kiện bơm trong quá trình vận chuyển bạch huyết. Các mao mạch bạch huyết phát triển các mối nối giống như nút để đóng vai trò là van chính cho chất lỏng và tế bào đi vào mạch bạch huyết.
Trong khi nguồn gốc của các LEC không tĩnh mạch này trong mạch bạch huyết ở da vẫn chưa rõ ràng, việc truy tìm dòng dõi đã chứng minh rằng ở nội mô tạo máu ở mạc treo chuột chuột đã góp phần tạo ra mạch bạch huyết mạc treo ngoài túi bạch huyết mạc treo có nguồn gốc từ tĩnh mạch (Hình 23B) ( 1018 ). Một cách độc lập, mã hóa gen được ghép nối giống như homeodomain 2 ( Pitx2 ) được phát hiện là cần thiết cho sự hình thành mạch bạch huyết mạc treo ruột, điều này cho thấy sự tồn tại của một quần thể tế bào tiền thân bạch huyết riêng biệt không phụ thuộc vào Prox1 ( 644 ).
Trong những năm qua, sự đa dạng của mạch bạch huyết ở các mô khác nhau đã thu hút được sự chú ý đáng kể. Ngoài các mô được biết đến là có mạch bạch huyết như da và mạc treo, mạch bạch huyết còn được phát hiện ở các mô khác trước đây được cho là có đặc quyền miễn dịch, bao gồm não và mắt ( 39 , 41 , 543 , 624 , 845 ). Điều này làm tăng khả năng khái niệm về đặc quyền miễn dịch có thể đã lỗi thời và không áp dụng được cho bất kỳ mô nào của cơ thể. Nguồn gốc của các mạch bạch huyết dành riêng cho mô này cũng rất đa dạng. Ví dụ, trong khi nguồn LEC tim chính là từ nội mô tĩnh mạch ngoài tim, nội mô tạo máu túi noãn hoàng cũng góp phần tạo ra một phần của mạch bạch huyết tim (Hình 23B) ( 543 ). Tuy nhiên, nguồn gốc của các mạch bạch huyết ở hệ thần kinh trung ương và ở mắt vẫn chưa rõ ràng. Tổng hợp lại, tất cả những phát hiện này đã cải thiện kiến thức của chúng ta về nguồn gốc khác nhau của mạch bạch huyết ở các cơ quan khác nhau, điều này cũng cho thấy tầm quan trọng của quá trình biệt hóa chuyển hóa trong cả điều kiện sinh lý và bệnh lý.
Đặc điểm kỹ thuật và di chuyển LEC
Mô hình từng bước về cách hình thành mạch bạch huyết liên quan đến các gen chính quy định đặc điểm LEC, sự nảy chồi và di cư trong quá trình phát triển phôi chuột đã được thiết lập rõ ràng và thảo luận trong nhiều bài đánh giá ( 40 , 184 , 803 , 968 , 1169 ). Tóm lại, các tế bào tiền thân Prox1 + LEC được chỉ định trong CV và ISV ở E9.5–E9.75 và phần lớn các tế bào này phát triển từ các gân ngay sau thông số kỹ thuật này. Ngay sau khi các tế bào tiền thân LEC đâm chồi ra khỏi tĩnh mạch, chúng biệt hóa thành các LEC trưởng thành biểu hiện thêm một protein LEC Podoplanin (Pdpn) ( 351 , 1168 ). Các Prox1 + Pdpn + LEC này sinh sôi nảy nở, di chuyển và tập hợp thành một cấu trúc giống như túi dọc theo trục trước và trục sau của phôi trên nửa sau của CV, được gọi là túi bạch huyết. Là nguồn cung cấp LEC chính, các túi bạch huyết tạo ra mạch bạch huyết khắp cơ thể, ngoại trừ các trường hợp ngoại lệ dành riêng cho cơ quan đã nêu ở trên (Hình 23A). Một số đánh giá đã tóm tắt chức năng của các yếu tố chính liên quan đến đặc tả LEC bao gồm ERK, Sox18, CoupTFII, Prox1, Flt4 và Notch ( 350 , 1169 ). Tín hiệu ERK kích hoạt biểu thức Sox18 trong CV ( 259 ), sau đó cả Sox18 và CoupTFII đều liên kết với vùng quảng bá của Prox1 để kích hoạt biểu thức của nó ( 349 , 1013 ). Biểu thức của Prox1 xác định đặc điểm kỹ thuật của LEC và hoạt động Prox1 là cần thiết để duy trì danh tính LEC trong suốt vòng đời ( 489 ). Ngoài Sox18, CoupTFII và Prox1 , một nhân tố chính khác trong việc duy trì danh tính LEC là Flt4 , mã hóa Vegfr3. Flt4 và Prox1 tương tác với nhau trong một vòng phản hồi trong đó Prox1 liên kết với trình khởi động Flt4 để duy trì biểu hiện của nó và Flt4 cũng cần thiết để duy trì biểu hiện của Prox1, do đó giúp duy trì danh tính LEC ( 1012 ). Trái ngược với Flt4, Notchl hoạt động như một bộ điều chỉnh tiêu cực của thông số kỹ thuật LEC. Hoạt động của Notch giảm dẫn đến số lượng tế bào tiền thân LEC trong tĩnh mạch tăng lên, dẫn đến dị tật mạch bạch huyết ( 738 ). Hơn nữa, biểu hiện của Prox1 được sửa đổi bởi microRNA. miR-181a và miR-31 điều chỉnh tiêu cực biểu hiện Prox1 trong LEC ( 528 , 854 ). Điều thú vị là gần đây người ta đã phát hiện ra rằng Wnt5b có khả năng tạo ra đặc điểm kỹ thuật LEC thông qua tín hiệu β-catenin ở cá ngựa vằn ( 765 ). Mặt khác, tín hiệu β-catenin không quan trọng đối với đặc điểm của tổ tiên LEC trong quá trình phát triển phôi chuột, nhưng lại cần thiết cho quá trình hình thành mạch bạch huyết ( 174 ).
Điều quan trọng là LEC phải tách ra khỏi tĩnh mạch và di chuyển để hình thành các túi bạch huyết và quá trình này cần có tín hiệu Vegfc/Vegfr3 ( 517 , 550 , 979 ). Con đường truyền tín hiệu này cũng đã được phát hiện là rất quan trọng đối với sự hình thành mạch bạch huyết mạc treo ( 1018 ), hình thành mạch bạch huyết ruột (lacteal) ( 88 , 776 ), hình thành mạch bạch huyết tim ( 543 ), hình thành mạch bạch huyết hệ thần kinh trung ương ( 39 , 624 ), và sự hình thành ống Schlemm ở mắt ( 41 , 845 ). Phôi chuột bị loại bỏ yếu tố collagen và canxi được tiết ra liên kết với miền EGF 1 ( Ccbe1 ) không có sự hình thành túi bạch huyết, tương tự như phôi loại bỏ Vegfc và cho thấy mối liên hệ giữa Ccbe1 và Vegfc ( 111 ). Nghiên cứu sâu hơn đã tiết lộ rằng Ccbe1 có thể tạo thành phức hợp với disintegrin và metallicoproteinase với mô típ Thrombospondin 3 (Adamts3) và chuyển Vegfc thành phối tử hoạt động ( 144 ). Do đó, Ccbe1 dường như neo Vegfc vào ma trận ngoại bào theo gradient nồng độ, nơi nó có thể được Adamts3 phân cắt và giải phóng bằng phương pháp phân giải protein.
Bên cạnh việc truyền tín hiệu Vegfc/Vegfr3, nhiều đường truyền tín hiệu khác cũng ảnh hưởng đến quá trình di chuyển LEC, chẳng hạn như đường dẫn tín hiệu adrenomedullin ( 354 ), angiopoietin 2 (Angpt2)-Tyrosine kinase với các miền giống immunoglobulin và giống EGF 1 (Tie1) (thụ thể Angpt2) con đường ( 227 , 874 ), PU.1 trong các đại thực bào ( 383 ), tín hiệu Nfatc1 ( 563 ) và tín hiệu qua trung gian yếu tố phiên mã Gata2 ( 606 ). Ở đây, chúng ta sẽ chủ yếu thảo luận về những phát hiện mới nhất trong ba năm qua vì những khám phá trước đó đã được đưa vào một đánh giá khác ( 1169 ). Việc mất tín hiệu adrenomedullin dẫn đến các túi bạch huyết giảm sản, điều này cho thấy khiếm khuyết trong quá trình di chuyển LEC ( 354 ). Gần đây người ta phát hiện ra rằng liều lượng và tín hiệu của adrenomedullin được kiểm soát chặt chẽ bởi thụ thể mồi nhử Cxcr7 . Việc xóa Cxcr7 dẫn đến mức tín hiệu adrenomedullin cao bất thường trong LEC và dẫn đến các túi bạch huyết chứa đầy máu mở rộng và các mạch bạch huyết ở da giãn ra ( 540 ).
Sự trao đổi chất của các tế bào nội mô máu đã được nghiên cứu trong nhiều năm về sức khỏe và ung thư ( 299 ). Một nghiên cứu gần đây tập trung vào việc chuyển hóa LEC ảnh hưởng như thế nào đến sự hình thành mạch máu này. Việc xóa CPT1A , một loại enzyme kiểm soát tốc độ oxy hóa β axit béo trong LEC, dẫn đến suy giảm hình thái bạch huyết. Về mặt cơ học, Prox1 trực tiếp điều chỉnh tăng cường biểu hiện CPT1A , làm tăng sản xuất acetyl coenzym A. Acetyl coenzym A được histone acetyltransferase p300 sử dụng để acetylate histone ở các gen tạo mạch bạch huyết, chẳng hạn như Vegfr3 để điều chỉnh sự di chuyển LEC và duy trì danh tính ( 1152 ).
Như đã đề cập trước đây, tín hiệu Notch rất quan trọng đối với đặc điểm kỹ thuật của LEC trong tĩnh mạch. Nó cũng điều chỉnh hình thái mạch bạch huyết. Việc xóa Notch1 đặc hiệu của LEC dẫn đến sự phát triển quá mức đáng kể của bạch huyết với các mạch bạch huyết bị giãn. Tăng sinh tế bào và hình thành filmaia cũng như giảm sự chết tế bào của LEC được thấy ở chuột đột biến Notch1 ( 320 ). Do đó, tín hiệu Notch là một bộ điều chỉnh tiêu cực quan trọng trong việc cân bằng số lượng LEC và sự di chuyển của chúng. Ngoài Notch1, Bmp2 còn có chức năng điều chỉnh tiêu cực trong quá trình tạo mạch bạch huyết. Bmp2 ngăn chặn biểu thức Prox1 thông qua hoạt động Smad1/5/8. miR-181a và miR-31 hoạt động như các mục tiêu xuôi dòng của tín hiệu Bmp2 để điều chỉnh tiêu cực biểu hiện Prox1 ( 293 ).
Tín hiệu phân cực tế bào phẳng (PCP) đóng một vai trò quan trọng trong nhiều quá trình phát triển. Các thành phần của con đường truyền tín hiệu PCP cũng tham gia vào sự phát triển của hệ bạch huyết ( 1053 ). Polycystin 1 (Pkd1) là một gen mới được xác định có chức năng điều hòa quá trình tạo mạch bạch huyết trong hai nghiên cứu đối tiếp. Trong quá trình hình thành mạch bạch huyết, Pkd1 không tham gia vào quá trình nảy chồi của LEC ra khỏi tĩnh mạch nhưng kiểm soát sự di chuyển của LEC trong quá trình hình thành mạch bằng cách điều chỉnh sự phân cực của tế bào ( 210 ). Mất Pkd1 dẫn đến sự di chuyển ngẫu nhiên của LEC và giảm mật độ mạch bạch huyết ( 826 ).
Sự trưởng thành của mạch bạch huyết và huy động tế bào cơ trơn
Từ E10.5 đến E14.5 trong quá trình phát triển phôi chuột, LEC sinh sôi nảy nở và di chuyển đến hầu hết mọi nơi trong cơ thể. Sau E14.5, LEC bắt đầu chuyển sang các loại tàu chuyên dụng hơn (Hình 23C). Như đã đề cập trước đó, hai loại mạch bạch huyết chung là mạch bạch huyết thu thập và mao mạch bạch huyết, có hình thái và chức năng riêng biệt. Các mạch bạch huyết thu thập được bao phủ bởi SMC. Các SMC chịu trách nhiệm co các mạch bạch huyết thu thập để đẩy bạch huyết về phía trước ( 956 ). Các mạch bạch huyết góp cũng có van trong lòng mạch để ngăn bạch huyết chảy ngược ( 159 , 947 ). Các mạch bạch huyết thu thập và mao mạch bạch huyết có các loại mối nối tế bào-tế bào khác nhau. Các mạch bạch huyết thu thập có các mối nối giống như dây kéo liên tục tương tự như nội mô mạch máu, trong khi các mao mạch có các mối nối giống như nút không liên tục được hình dung bằng cách nhuộm màu cho phân tử mối nối VE-cadherin ( Cdh5 ) ( 61 ). Các nút trên mao mạch bạch huyết được coi là hoạt động như van chính để chất lỏng và tế bào đi vào mạch bạch huyết. Về mặt phát triển, các mạch bạch huyết khí quản có các LEC được nối với nhau bằng các mối nối giống như dây kéo trước E16.5. Tuy nhiên, tỷ lệ các điểm nối giống nút tăng từ 6% ở E17.5 và 12% ở E18.5 lên 35% khi mới sinh, 50% ở ngày sau sinh P7, 90% ở P28 và 100% ở P70, điều này cho thấy sự trưởng thành của các mối nối mao mạch bạch huyết. Các giá trị tương tự cũng được thấy ở các mao mạch bạch huyết của cơ hoành. Trong thời kỳ này, các mối nối giống như dây kéo trong các mạch bạch huyết thu thập vẫn không thay đổi ( 1171 ). Mặc dù các lực liên quan đến việc chuyển đổi khóa kéo thành nút vẫn chưa rõ ràng, nhưng lượng chất lỏng cần được làm sạch ngày càng tăng có thể ảnh hưởng đến việc tái cấu trúc các mối nối trong mao mạch bạch huyết. Angiopoietin 2 (Angpt2) không thể thiếu cho sự trưởng thành của các mối nối tế bào-tế bào trong mao mạch bạch huyết do việc xóa gen Angpt2 ngăn cản sự chuyển đổi mối nối từ khóa kéo sang nút ( 1218 ).
Tuy nhiên, liên quan đến mao mạch bạch huyết, nhiều nghiên cứu đã được thực hiện về sự trưởng thành của việc thu thập các mạch bạch huyết. Sự điều hòa giảm của các gen mao mạch trong các mạch bạch huyết thu thập, huy động SMC và hình thành van là những bước quan trọng trong quá trình trưởng thành của các mạch bạch huyết thu thập. Tín hiệu đầu não c2 (Foxc2)/calcineurin/Nfatc1 là một đường truyền tín hiệu đã được nghiên cứu kỹ lưỡng, rất cần thiết cho sự trưởng thành của việc thu thập các mạch bạch huyết. Foxc2 và Nfatc1 liên kết hợp tác với các yếu tố điều hòa của gen bạch huyết để kiểm soát sự biểu hiện của chúng. Trong mạc treo giàu mạch bạch huyết thu thập, mất Foxc2 dẫn đến việc duy trì mức độ biểu hiện cao của gen Prox1, Flt4 và Lyve1 trong đám rối mạch bạch huyết nguyên thủy và các mạch bạch huyết này có độ bao phủ SMC quá mức. Thụ thể beta của yếu tố tăng trưởng có nguồn gốc từ tiểu cầu ( Pdgfrb ) rất cần thiết cho việc huy động các tế bào ngoại vi bằng cách phát triển các mao mạch máu ( 430 , 607 ). Foxc2 thu thập các mạch bạch huyết biểu hiện biểu hiện không được kiểm soát của Pdgfrb . Những mạch máu này không có khả năng biệt hóa thành các mạch bạch huyết thu thập chức năng và thiếu van, biểu hiện bằng dòng bạch huyết chảy ngược ( 774 , 859 ). Flt4 là một ứng cử viên tiềm năng để điều chỉnh biểu hiện Foxc2 trong quá trình hình thành các mạch bạch huyết thu thập. Ở chuột dị hợp tử Flt4 , biểu hiện Foxc2 giảm ( 859 ). Hoạt động của Foxc2 cũng được điều hòa bởi kinase 5 phụ thuộc cyclin (Cdk5) bằng quá trình phosphoryl hóa ở dư lượng serine/threonine. Việc loại bỏ đặc hiệu tế bào nội mô của Cdk5 dẫn đến các mạch bạch huyết giãn nở chứa đầy máu và phù nề ( 603 ). Ngoài Foxc2 , gen Reln mã hóa cuộn protein cũng rất quan trọng cho sự trưởng thành của việc thu thập các mạch bạch huyết. Ở chuột đột biến Reln , các mạch bạch huyết thu thập vẫn giữ được biểu hiện cao của Lyve1 và có mức độ bao phủ SMC giảm. Phù hợp với độ bao phủ SMC thấp, tốc độ dòng bạch huyết cũng giảm trong các mạch bạch huyết thu thập, được biểu thị bằng xét nghiệm hấp thu thuốc nhuộm màu xanh lá cây indocyanine (ICG). Về mặt cơ học, protein reelin được tiết ra có thể hoạt động như một chất truyền tin trong việc gắn kết các SMC với việc thu thập các mạch bạch huyết ( 633). Ngoài ra, tín hiệu Angpt2-Tie1 gần đây đã được công bố để đóng vai trò thu thập sự trưởng thành của bạch huyết. Đầu tiên, việc ức chế Angpt2 bằng cách sử dụng kháng thể kháng Angpt2 dẫn đến các mạch bạch huyết thu thập chưa trưởng thành có biểu hiện Lyve1 cao và khả năng vận chuyển bạch huyết bị khiếm khuyết trong các mạch đó. Trong khi đó, các mao mạch bạch huyết có sự bao phủ SMC ngoài tử cung ở chuột thiếu Angpt2 ( 1218 ). Tương tự, việc xóa Tie1 cho thấy sự biểu hiện dai dẳng của dấu hiệu mao mạch bạch huyết Lyve1 trong các mạch bạch huyết thu thập, cho thấy sự suy giảm của Tie1 ngăn cản sự hình thành các mạch bạch huyết thu thập. Hơn nữa, sự bao phủ bất thường của SMC trong mao mạch bạch huyết cũng được thấy ở chuột bị loại Tie1 ( 875 , 975 ). Cùng với nhau, tín hiệu Angpt2-Tie1 rất quan trọng cho sự trưởng thành của cả mạch bạch huyết thu thập và mao mạch bạch huyết.
Sự hình thành van bạch huyết
Van bạch huyết là một phần không thể thiếu của mạch bạch huyết. Chúng rất quan trọng để duy trì sự vận chuyển bạch huyết theo một hướng. Chúng bao gồm hai lá van, mỗi lá có một lõi ma trận ngoại bào (ECM) được lót bởi một lớp LEC ở mỗi bên của lá van ( 582 , 753 , 939 , 945 ). Van bạch huyết hình thành như thế nào đã trở thành một chủ đề nóng trong vài năm qua. Một số quá trình truyền tín hiệu rất quan trọng đối với sự hình thành các van bạch huyết, bao gồm các yếu tố phiên mã, protein nối, ECM và gen hướng dẫn sợi trục ( 1169 ). Ở đây chúng tôi sẽ giới thiệu những hiểu biết mới nhất về sự hình thành các van trong toàn bộ mạch bạch huyết.
Thu thập các van mạch bạch huyết
Các van trong mạch bạch huyết thu thập mạc treo bắt đầu hình thành trong phôi xung quanh E15.5. Sự hình thành van bạch huyết có ít nhất bốn bước được xác định. Bước một (bắt đầu, E15.5–E16.5): một cụm LEC hình thành ở một bên của mạch bạch huyết thu thập; Bước hai (ngưng tụ, E16.5–E17.5): cụm LEC tạo ra sự co thắt dạng vòng; Bước ba (độ giãn dài, E17.5-E18.5): điểm thắt giống vòng LEC phát triển vào trong lòng mạch cùng với sự lắng đọng ECM; Bước bốn (trưởng thành, E18.5-): hình thành hai tờ rơi. Foxc2 là chất điều hòa chính cho sự hình thành van bạch huyết. Chuột bị loại toàn cầu Foxc2 không phát triển bất kỳ van bạch huyết nào và chết chu sinh ( 859 ). Trong quá trình phát triển phôi, ứng suất cắt chất lỏng tăng lên trong các mạch bạch huyết thu thập và nồng độ Foxc2 và Prox1 tăng theo vùng là nguyên nhân gây ra đặc điểm kỹ thuật của các tế bào van ( 944 ). Foxc2 và Prox1 điều chỉnh sự biểu hiện của tín hiệu connexin-37 ( Cx37 ) và calcineurin/Nfatc để đáp ứng với dòng chảy nhằm tạo điều kiện cho sự xuất hiện của vùng van bạch huyết ( 513 , 944 ). Cx37 điều chỉnh quá trình chuyển đổi từ cụm tế bào hình thành van sớm sang lãnh thổ van bạch huyết dạng vòng. Mất Cx37 ức chế sự hình thành các van bạch huyết và dẫn đến sự dẫn lưu bạch huyết bất thường nghiêm trọng ( 944 ). Khi dòng chảy dao động, Foxc2 và Prox1 kiểm soát việc tái tổ chức bộ xương tế bào và sự liên kết tế bào của tế bào hình thành van để đẩy nhanh quá trình hình thành van ( 944 ). Foxc2 không chỉ quan trọng trong việc hình thành van bạch huyết mà còn giúp duy trì van sau sinh. Việc xóa Foxc2 ở chuột con sau sinh dẫn đến cổ chướng dưỡng trấp và tràn dịch màng phổi. Sự xẹp lòng mạch và thoái hóa các van bạch huyết đã được quan sát thấy ở những chú chó con này, điều này được chứng minh bằng thực tế là cả tổng số van và số lượng van với hai tờ rơi bình thường đều giảm đáng kể. Về mặt cơ học, sự bất hoạt của Foxc2 gây ra cảm giác ứng suất cắt bất thường trong nuôi cấy tế bào và các khiếm khuyết trong các mối nối tế bào-tế bào được thể hiện bằng nhuộm VE-cadherin ( 945 ). Những kết quả này cho thấy ứng suất cắt dao động đóng một vai trò quan trọng trong việc hình thành van. Trong khi đó, yêu cầu về dòng bạch huyết trong quá trình hình thành van đã được kiểm tra trực tiếp trên mô hình chuột. Thụ thể đặc hiệu tiểu cầu Thụ thể giống lectin loại C 2 ( Clec2 ) là thụ thể duy nhất được biết đến đối với podoplanin. Các nghiên cứu gần đây đã chỉ ra rằng cần phải kích hoạt tiểu cầu bằng cách thắt Clec2 và podoplanin để ngăn máu đi vào mạng lưới mạch bạch huyết và Clec2những con chuột bị thiếu hụt sẽ có các mạch bạch huyết chứa đầy máu ( 92 , 331 , 1092 ). Bằng cách tận dụng lợi thế của việc bổ sung máu vào các mạch bạch huyết, ngăn chặn dòng bạch huyết trong mạc treo, các tác giả đã có thể chỉ ra rằng những con chuột bị thiếu Clec2 biểu hiện sự phát triển bình thường của đám rối bạch huyết mạc treo ruột nguyên phát nhưng không hình thành được van trong các mạch này. . Độ bao phủ của SMC đối với các mạch bạch huyết bị thiếu Clec2 cũng cao bất thường ( 1035 ). Như vậy, kiểu hình của chuột thiếu hụt Clec2 tương tự như chuột thiếu Foxc2 . Đây là bằng chứng mạnh mẽ cho thấy dòng bạch huyết trực tiếp điều chỉnh sự hình thành van.
Hơn nữa, các thí nghiệm in vitro trên LEC nuôi cấy cho thấy ứng suất cắt dao động gây ra sự biểu hiện của các gen cần thiết cho sự phát triển van bạch huyết, chẳng hạn như Foxc2, Cx37, integrin α9 (Itga9) và Gata2 ( 944 , 1035 ). Gata2 là yếu tố phiên mã được biểu hiện cao trong các tế bào van ( 529 ) và cần thiết cho quá trình điều hòa lại Foxc2, Cx37 và Itga9 trong LEC nuôi cấy khi có ứng suất cắt dao động. Nó chỉ ra rằng Gata2 là chất điều hòa ngược dòng của các gen van bạch huyết này ( 527 , 1035 ). Gata2 đã được chứng minh là có thể điều chỉnh biểu thức Prox1 bằng cách liên kết với phần tử tăng cường giả định ngược dòng của Prox1 . Việc xóa Gata2 trong phôi chuột dẫn đến phù nề nghiêm trọng. Không có van nào được hình thành trong mạch bạch huyết thu thập ở mạc treo ruột. Việc xóa Gata2 sau sinh dẫn đến tình trạng mất tổ chức các van và mạch bạch huyết dạng củ ( 527 ). Những dữ liệu này minh họa rằng Gata2 rất cần thiết cho cả việc bắt đầu và duy trì van bạch huyết.
Ngoài ra, các tín hiệu từ ECM rất quan trọng cho sự hình thành van bạch huyết. Người ta đã chứng minh rằng chuột thiếu Itga9 có số lượng van bạch huyết giảm, các van còn lại có hình thái bất thường ( 72 , 73 , 432 ). Điều thú vị là, chuột bị loại bỏ polydom phối tử Itga9 (còn được đặt tên là Svep1 ) biểu hiện chứng phù nề nghiêm trọng. Polydom được tiết ra từ các tế bào trung mô và lắng đọng xung quanh các mạch bạch huyết. Biểu hiện Foxc2 đã giảm ở chuột polydom -/- . Những động vật này chưa trưởng thành trong việc thu thập các mạch bạch huyết và van bạch huyết ( 522 , 727 ). Trước đây đã đề cập rằng Notch1 điều chỉnh tiêu cực biểu thức Prox1 trong quá trình đặc tả LEC. Notch1 cũng đóng vai trò trong sự phát triển van bạch huyết bằng cách điều chỉnh các yếu tố chính hình thành van, Cx37, Itga9 và fibronectin ( FNEIIIA ). Sự mất tín hiệu Notch đặc hiệu nội mô bạch huyết dẫn đến sự hình thành van bị khiếm khuyết và giảm biểu hiện FNEIIIA và Itga9 ( 739 ). Tổng hợp lại, những dữ liệu này đã chứng minh rằng ứng suất cắt dao động, protein nối và protein ECM đóng vai trò quan trọng trong việc hình thành van.
Trong quá trình hình thành lá van, LEC trải qua quá trình kéo dài, định hướng lại và di chuyển vào trong lòng mạch. Các protein phân cực tế bào phẳng Celsr1 và Vangl2 điều chỉnh sự sắp xếp lại và định hướng lại của các tế bào hình thành van, điều này rất quan trọng cho sự hình thành van bạch huyết. Sự hình thành van bị bãi bỏ ở chuột Celsr1- hoặc Vangl2-null ( 1053 ). Gần đây , heparan sulfate proteoglycan Syndecan-4 ( Sdc4 ) xuyên màng (loại I) đã được chứng minh là có khả năng kiểm soát sự phân cực LEC thông qua việc điều chỉnh biểu hiện Vangl2 . Việc xóa Sdc4 ở chuột dẫn đến hình thái van bất thường ( 1123 ). Trước đây, đã có báo cáo rằng các gen hướng dẫn sợi trục semaphorin 3A ( Sema3a ), các thụ thể của nó là Neuropilin-1 ( Nrp1 ), plexin A1 ( Plxna1 ) và ephrin B2 , một thành viên của họ tyrosine kinase thụ thể Eph, cần thiết cho sự hình thành van bạch huyết ( 72 , 117 , 501 , 646 ). Gần đây, một nghiên cứu đã tiết lộ vai trò mới của thụ thể Eph B4 ( Ephb4 ) trong sự phát triển van bạch huyết. Việc phong tỏa EphB4 bằng kháng thể kháng EphB4 gây ra các khiếm khuyết bạch huyết rõ ràng, bao gồm dưỡng chấp ngực, giãn mạch bạch huyết và mất van bạch huyết ( 1206 ). Thật bất ngờ, các protein tiếp hợp liên kết với ubiquitin Epsin 1 và 2 điều chỉnh sự hình thành van bạch huyết thông qua tín hiệu Vegfr3. Người ta quan sát thấy rằng việc kích hoạt Vegfr3 sau khi liên kết với phối tử Vegfc của nó, sau đó là quá trình nội hóa thụ thể trong các mao mạch bạch huyết đang mọc lên ( 1146 ). Epsins tương tác vật lý với Vegfr3 theo mô-đun tương tác ubiquitin và được yêu cầu để nội hóa Vegfr3 sau khi liên kết với Vegfc. Mất Epsin dẫn đến việc duy trì biểu hiện Vegfr3 cao trong việc thu thập các mạch bạch huyết, ngăn chặn sự trưởng thành và hình thành các van của chúng, gây ra sự dẫn lưu bạch huyết bị khiếm khuyết. Điều thú vị là, hoạt động của Vegfr3 giảm ở những con chuột này đã phục hồi sự hình thành van bạch huyết bình thường và cải thiện chức năng bạch huyết ( 617 ). Nghiên cứu này thực sự đã tiết lộ rằng sự biến đổi sau phiên mã của các gen bạch huyết ảnh hưởng đến sự phát triển của van bạch huyết.
Van bạch huyết
Van bạch huyết là các van chuyên dụng nơi ống ngực đổ vào mạch máu ở các tĩnh mạch dưới đòn. Trong quá trình hình thành túi bạch huyết, hầu hết các LEC tách ra khỏi tĩnh mạch và biệt hóa thành các LEC trưởng thành hơn để hình thành các mạch bạch huyết. Tuy nhiên, một lượng nhỏ LEC vẫn còn trong CV và trở thành các lá van bạch huyết tạo nên điểm nối giữa túi bạch huyết cảnh với tĩnh mạch cảnh và tĩnh mạch dưới đòn trong quá trình phát triển phôi thai ( 1101 ). Một van bạch huyết nằm giữa tĩnh mạch dưới đòn và tĩnh mạch cảnh ngoài. Một van bạch huyết khác nằm giữa tĩnh mạch cảnh ngoài và tĩnh mạch cảnh trong. Các van bạch huyết điều chỉnh sự trở lại của dịch bạch huyết vào tuần hoàn máu và ngăn máu đi vào mạch bạch huyết.
Khi van bạch huyết bị thiếu hoặc bị biến dạng sẽ dẫn đến các mạch bạch huyết chứa đầy máu ( 1014 ). Có báo cáo cho rằng tiểu cầu cần thiết để tách các túi bạch huyết khỏi tĩnh mạch tại điểm kết nối của chúng – các van bạch huyết ( 92 , 154 , 331 , 819 , 1092 ). Sự gắn kết giữa các LEC van bạch huyết biểu hiện podoplanin và thụ thể tiểu cầu Clec2 là rất quan trọng cho sự bắt đầu kết tập tiểu cầu. Ở chuột thiếu Clec2 , huyết khối tiểu cầu chứa fibrin bị thiếu ở van bạch huyết, dẫn đến các mạch bạch huyết chứa đầy máu. Hơn nữa, huyết khối tiểu cầu lớn hơn nhiều ở động vật thiếu van bạch huyết và van bạch huyết, cho thấy huyết khối tiểu cầu có thể bù đắp cho việc mất van bạch huyết và van bạch huyết để duy trì sự phân tách máu-bạch huyết ( 432 ). Tương tự như quá trình hình thành van bạch huyết thu thập, quá trình hình thành van bạch huyết bao gồm ba bước biến đổi chính của LEC: Tách lớp (E12.0), Kết tụ (E12.5) và Trưởng thành (E14.5-E16.5). Về mặt di truyền, nhiều gen quan trọng cho sự hình thành các van bạch huyết góp cũng rất quan trọng cho sự hình thành van bạch huyết. Các yếu tố phiên mã Prox1, Foxc2 và Gata2 được biểu hiện cao ở van bạch huyết và van bạch huyết ( 373 ). Động vật dị hợp tử Prox1 hoàn toàn thiếu van bạch huyết ( 1014 ). Động vật dị hợp tử Foxc2 có kiểu hình thay đổi. Một nửa số động vật phát triển một van bạch huyết thay vì hai van. Và trong phôi loại Gata2 , không có van bạch huyết được biệt hóa chính xác ( 373 , 527 ).
Điều thú vị là gần đây β-catenin đã được báo cáo là liên kết trực tiếp với vùng khởi động của Foxc2 và Prox1 để điều chỉnh sự hình thành van bạch huyết. β-catenin được biểu hiện cao ở cả van thu thập mạch bạch huyết và van bạch huyết. Mất gen mã hóa β-catenin, Ctnnb1 , dẫn đến không có van bạch huyết ở mạc treo và không có van bạch huyết. Trong LEC nuôi cấy, β-catenin được chứng minh là cần thiết cho việc điều hòa lại các gen hình thành van Foxc2 và Gata2 để đáp ứng với ứng suất cắt dao động. Do đó, tín hiệu β-catenin là yếu tố điều chỉnh quan trọng cho sự hình thành van ( 174 ). Ngoài ra, Ephb4 không chỉ quan trọng trong việc thu thập sự hình thành van mạch bạch huyết mà còn rất quan trọng trong việc hình thành van bạch huyết.
Sự bất hoạt của Ephb4 trong LEC dẫn đến sự hình thành van bạch huyết bị khiếm khuyết và hậu quả là phù dưới da ( 655 ). Là thành phần chính của van, ECM cũng đóng vai trò quan trọng trong việc hình thành van bạch huyết. Trước đây người ta đã đề cập rằng chuột thiếu Itga9 phát triển van bạch huyết bị khiếm khuyết. Nhưng van bạch huyết đã được báo cáo là bình thường ở những con chuột này ( 72 , 73 , 432 ). Thay vào đó, đột biến Itga5 biểu hiện những khiếm khuyết trong quá trình hình thành các van bạch huyết. Những con chuột này phát triển các mạch bạch huyết giãn nở, chứa đầy máu và các mao mạch bạch huyết được bao phủ ngoài tử cung bằng SMC ( 1087 ). Nó chỉ ra rằng mặc dù van bạch huyết và van bạch huyết có nhiều điểm tương đồng nhưng sự hình thành của van bạch huyết và van bạch huyết có cơ chế riêng biệt.
Sự phát triển và bệnh bạch huyết
Cho đến nay chúng ta đã thảo luận về quá trình phát triển của mạch bạch huyết và các gen tương ứng của chúng. Điều thú vị là những đột biến ở nhiều gen đó lại gây ra các bệnh về bạch huyết ở người. Phù bạch huyết nguyên phát là một bệnh bạch huyết chính ở người. Đột biến trong gen đặc tả LEC SOX18 đã được xác định là nguyên nhân gây ra bệnh phù bạch huyết-giãn mao mạch ở người ( 464 ). Trong con đường truyền tín hiệu đặc tả LEC, các đột biến ở RAF1 liên tục kích hoạt tín hiệu MAPK/ERK và có liên quan đến hội chứng Noonan, một căn bệnh bao gồm giãn mạch bạch huyết ( 36 , 1071 ). Các đột biến dị hợp tử ở FLT4 ở người ảnh hưởng đến các vùng tyrosine kinase VEGFR3 dẫn đến các khiếm khuyết mạch bạch huyết và phù bạch huyết nguyên phát (bệnh Milroy) ( 385 , 465 , 516 , 519 ). Tín hiệu VEGF-C/VEGFR3 hoạt động thông qua con đường Akt (protein kinase B) ( 260 ). Akt cần thiết cho sự hình thành mạch bạch huyết và phát triển van ( 1219 ). Đột biến ở 3-kinase loại I phosphoinositide ( PI3K ) dẫn đến tăng phospho AKT có liên quan đến Dị tật bạch huyết (LM) ở người ( 112 ). Đột biến yếu tố di cư CCBE1 của LEC ở người gây ra một loại chứng loạn sản bạch huyết được gọi là hội chứng Hennekam ( 22 , 201 , 202 ). Đột biến điểm ở FOXC2 ở người có liên quan đến hội chứng phù bạch huyết-distichosis (LD) ( 132 , 317 ), trong đó van bạch huyết bị khiếm khuyết. Đột biến trong yếu tố phiên mã hình thành van GATA2 gây ra hội chứng Emberger, hội chứng rối loạn sinh tủy (MDS), bệnh bạch cầu dòng tủy cấp tính (ALS) và hội chứng “MonoMAC” với phù bạch huyết nguyên phát ( 529 , 822 ). Protein mối nối connexin-47 (Cx47) được biểu hiện cao ở các van bạch huyết ( 513 ). Đột biến ở CX47 có liên quan đến chứng phù bạch huyết nguyên phát ở người ( 327 , 821 ). Một đột biến bất hoạt ở gen di truyền PCP CELSR1 gần đây đã được phát hiện có liên quan đến chứng phù bạch huyết di truyền ( 382 ). Các đột biến làm mất hoạt tính tyrosine kinase của EPHB4 (rất quan trọng cho sự hình thành van) có liên quan đến dạng bệnh phù thai nhi di truyền trội, liên quan đến bạch huyết (không miễn dịch) (LRHF) ( 655). Tương tự, bệnh tràn dịch màng phổi bẩm sinh ở bào thai người là do đột biến gen hình thành van ITGA9 ( 635 ). Tyrosine phosphatase không thụ thể (Ptpn14) có thể tương tác với Vegfr3 và ảnh hưởng đến quá trình tạo mạch bạch huyết. Các đột biến trong PTPN14 có liên quan đến hội chứng phù bạch huyết-lưng nhiễm sắc thể lặn-hẹp, biểu hiện kiểu hình phù bạch huyết ở người ( 43 ). Chuột thiếu protein kích hoạt Ras GTPase ( Rasa1 ) biểu hiện mất van bạch huyết, tăng sản, giãn nở và rò rỉ mạch bạch huyết và dưỡng chấp. Ở người, đột biến RASA1 gây dị tật mao mạch-động tĩnh mạch (CM-AVM) ( 577 , 578 ). Yếu tố phiên mã T-Box 1 ( Tbx1 ) đóng vai trò quan trọng trong sự phát triển mạch bạch huyết và điều chỉnh sự biểu hiện của Vegfr3 bằng cách liên kết với yếu tố tăng cường trong gen Flt4 ( 186 ). Đột biến Tbx1 có liên quan đến hội chứng DiGeorge; tuy nhiên, các khiếm khuyết về bạch huyết cho đến nay chỉ được báo cáo một lần dưới dạng loạn sản bạch huyết ở bụng ở bệnh nhân mắc hội chứng DiGeorge ( 649 , 1162 ). Mặc dù chức năng phát triển của Kruppel Like Factor 11 ( KLF11 ) vẫn chưa rõ ràng, nhưng các đột biến của nó gây ra hội chứng loạn sản đầu nhỏ-phù bạch huyết-màng não (MLCRD) ( 427 , 823 ). Gần đây hơn, các đột biến dị hợp tử đồng hợp tử và dị hợp tử ở PIEZO1 (mã hóa kênh ion được kích hoạt cơ học), dẫn đến dạng lặn nhiễm sắc thể thường của chứng loạn sản bạch huyết tổng quát (GLD) với tỷ lệ cao mắc bệnh phù thai không miễn dịch và khởi phát bệnh ở mặt và tứ chi ở trẻ em. phù bạch huyết. Nó chỉ ra chức năng tiềm năng của PIEZO1 trong sự phát triển bạch huyết ( 346 ).
Sự hình thành bạch huyết và mối quan hệ với sự hình thành mạch trong quá trình tu sửa mạng lưới vi mạch
Sự phát triển và rối loạn chức năng của mạng bạch huyết liên quan đến phù bạch huyết, viêm, di căn ung thư và các tình trạng bệnh lý khác nêu bật sự cần thiết phải hiểu rõ hơn về bản chất năng động của cấu trúc mạng bạch huyết ở cấp độ mạch, tế bào và phân tử ( 481 , 521 , 1017 ). Trong những năm gần đây, các mô hình mô toàn phần đã cung cấp cái nhìn sâu sắc về tổ chức mạng lưới bạch huyết và các cơ chế liên quan đến sự phát triển của mạch bạch huyết, tức là sự hình thành mạch bạch huyết ( 61 , 848 , 978 ). Do tầm quan trọng về mặt chức năng của mạng lưới bạch huyết đối với cân bằng nội môi mô và buôn bán tế bào miễn dịch, việc thiết kế các liệu pháp dựa trên phân tử nhằm điều khiển vi tuần hoàn đòi hỏi phải hiểu được mối quan hệ giữa quá trình tạo mạch bạch huyết và sự hình thành mạch, sự phát triển tương tự của các mạch máu mới. Những câu hỏi quan trọng vẫn chưa được trả lời: Sự hình thành mạch máu và sự hình thành mạch bạch huyết có liên quan đến mức độ nào? Mạch bạch huyết có thể trở thành mạch máu và ngược lại? Các mao mạch máu có thể chảy trực tiếp vào các mạch bạch huyết ban đầu không? Việc tập trung vào quá trình tạo mạch bạch huyết và mối tương quan giữa bạch huyết và mạch máu trong quá trình phát triển mạng lưới vi mạch làm nổi bật lĩnh vực nghiên cứu mới nổi này (Hình 24).

Hình ảnh đại diện của mô hình mạng lưới bạch huyết ban đầu ở mô mạc treo chuột trưởng thành. Ghi nhãn PECAM xác định cả tế bào nội mô bạch huyết và máu trên hệ thống phân cấp của mạng lưới nguyên vẹn. Các mạch bạch huyết có thể được phân biệt dựa trên cường độ ghi nhãn nhẹ hơn và đường kính tăng lên. A) Hình ảnh của một mạng lưới vi mạch chứa cả mạch bạch huyết và mạch máu. B) Hình ảnh vùng mạng lưới vi mạch chỉ chứa các mạch bạch huyết. Lưu ý ngay cả ở vùng chỉ có bạch huyết, có thể quan sát thấy các đoạn nội mô bị ngắt kết nối đặc trưng của mầm mao mạch máu. C) Ví dụ về sự phối hợp rõ ràng giữa mao mạch máu và bạch huyết. D) Ví dụ về mối liên hệ rõ ràng giữa mao mạch máu và bạch huyết. Thanh tỷ lệ: A, B = 500 m, C = 100 m, D = 200 m.
Sự hình thành bạch huyết
Quá trình tạo bạch huyết là quá trình tăng trưởng bạch huyết trong đó các mạch bạch huyết ban đầu mới được hình thành từ các mạch có sẵn. Trong khi các phương thức tạo mạch bạch huyết có thể bao gồm lồng ruột (tức là tách mạch) hoặc các động lực ít đặc trưng khác như di chuyển và tái kết nối tế bào nội mô ( 481 , 798 , 936 ), thì sự đóng góp tương đối của các phương thức này vào sự phát triển của mạng lưới vẫn chưa rõ ràng. Hiện nay, sự nảy mầm của tế bào nội mô bạch huyết là phương thức phát triển được mô tả rõ ràng nhất. Các mao mạch bạch huyết đầu tiên hình thành nên các sợi nấm mịn trước khi hình thành mầm ( 63 , 80 ), tương tự như các mao mạch trong quá trình hình thành mạch ban đầu từ các mạch máu hiện có. Những mầm này sinh sôi nảy nở và mở rộng để hình thành các mạch bạch huyết trưởng thành mới, có đầu bịt mù. Bằng chứng hiện tại cho thấy sự nảy mầm của bạch huyết chủ yếu qua trung gian VEGFR3 được biểu hiện bởi các tế bào nội mô bạch huyết. VEGFR3 là một thụ thể tyrosine kinase được kích hoạt bởi VEGF-C và VEGF-D ( 621 ). VEGF-C và -D cũng liên kết với Neuropilin-2 (Nrp2), một thụ thể xuyên màng có vai trò hướng dẫn sợi trục phát triển. Nrp2 được cho là hoạt động như một đồng thụ thể cho VEGFR3 và là chất trung gian cho sự nảy mầm của bạch huyết ( 1161 ). Đáng chú ý, trong một nghiên cứu gần đây với việc loại bỏ không hoàn toàn VEGFR3 sau khi sinh, dẫn đến khảm các tế bào nội mô bạch huyết VEGFR3+ và VEGFR3-, quá trình tạo mạch bạch huyết thực sự đã được tăng cường, với các tế bào VEGFR3+ di chuyển đến đầu các tế bào đang nảy mầm. Các tế bào VEGFR3+ có khả năng tăng sinh quá mức do sự điều hòa Notch phụ thuộc vào sự tiếp xúc giữa tế bào và tế bào bởi các tế bào VEGFR3- lân cận ( 1216 ). VEGF-C cũng đã được chứng minh là có tác dụng kích thích sự hình thành mạch bằng cách kích hoạt VEGFR2 ( 621 ). Trong khi đó, danh sách các yếu tố tăng trưởng chủ yếu tạo mạch cũng tham gia vào quá trình tạo mạch bạch huyết ngày càng tăng ( 621 ). Chúng bao gồm VEGF-A ( 412 ) và bFGF ( 149 ). Sự chồng chéo cho thấy mối quan hệ cơ bản giữa hai quá trình, dẫn đến việc điều tra sự tương tác của chúng trong mạng lưới vi mạch (Hình 25). Kiến thức thu được từ những nghiên cứu đang diễn ra này dự kiến sẽ cải thiện mục tiêu của các phương pháp trị liệu nhằm điều khiển sự phát triển của máu và bạch huyết.

Hình ảnh đại diện cho sự phát triển đồng thời của mạng lưới vi mạch máu và bạch huyết trong cùng một mô mạc treo chuột trưởng thành. Mạng lưới vi mạch máu tạo mạch (trên) và mạng lưới bạch huyết tạo mạch (phía dưới) dường như đang phát triển về cùng một không gian kẽ vô mạch. Ví dụ này thúc đẩy lĩnh vực nghiên cứu sinh học bạch huyết mới nổi tập trung vào động lực phân tử và tế bào chung liên quan đến sự phối hợp tăng trưởng giữa hai hệ thống. Thanh tỷ lệ = 500 m.
Mối quan hệ giữa quá trình tạo bạch huyết và sự hình thành mạch
Các phân tích về mạng lưới vi mạch bằng kính hiển vi trong tử cung và phương tiện tương phản trước đây đã gợi ý rằng mạng lưới bạch huyết vẫn khác biệt với mạng lưới vi mạch máu trong các mô trưởng thành ( 191 , 421 , 963 , 1094 ). Tuy nhiên, danh sách ngày càng tăng các yếu tố tăng trưởng phổ biến liên quan đến cả quá trình tạo mạch bạch huyết và tạo mạch cho thấy rằng có thể có sự tương tác ở cấp độ mao mạch. Khái niệm về mô hình sai mạch bạch huyết/mạch máu được hỗ trợ thêm bởi sự tương đồng về kiểu hình giữa tế bào nội mô bạch huyết và máu trong điều kiện không hoạt động và một số điều kiện bệnh lý nhất định ( 521 , 1017 ). Những quan sát gần đây hơn cho thấy rằng các tế bào nội mô trên thực tế có khả năng hình thành các kết nối, được xác định bằng sự gắn nhãn liên tục dưới micron của các phân tử kết dính tế bào nội mô, giữa bạch huyết và mạch máu ở cấp độ mao mạch trong mạng lưới vi mạch của chuột trưởng thành ( 914 ). Mặc dù ý nghĩa chức năng của các kết nối và liệu chúng có thể cung cấp các vị trí dẫn chất lỏng trực tiếp hay không vẫn chưa được nghiên cứu kỹ, nhưng những quan sát mô tả này nhấn mạnh sự cần thiết phải điều tra các cơ chế tế bào và phân tử phổ biến liên quan đến sự phát triển của bạch huyết và mạch máu.
Sự phối hợp chặt chẽ giữa máu và mạch bạch huyết bắt đầu trong quá trình phát triển. Khi hệ thống mạch máu đang phát triển, một quần thể tế bào nội mô tĩnh mạch bắt đầu biểu hiện yếu tố phiên mã đặc hiệu bạch huyết Prox1 và chồi ra khỏi tĩnh mạch chính, hình thành các túi bạch huyết đầu tiên mà sau này trưởng thành vào hệ thống mạch bạch huyết ( 1140 ). Điểm chung của nhiều yếu tố tăng trưởng cũng cho thấy có thể tồn tại những tương tác sinh lý lớn hơn giữa hai hệ thống này. Bằng chứng cho điều này được đưa ra bởi Benest và cộng sự, người đã chứng minh rằng sự hiện diện của mạch bạch huyết ảnh hưởng đến sự hình thành mạch do VEGF-C gây ra ( 80 ). Ngoài ra, Nakao và cộng sự. cho rằng VEGFR-2 được biểu hiện bởi các mạch máu tạo mạch đã cản trở quá trình tạo mạch bạch huyết bằng cách cô lập VEGF-C ( 748 ). Thật vậy, các tín hiệu phân tử tạo mạch như VEGF và angiopoietin đóng vai trò tương tự trong quá trình tạo mạch bạch huyết ( 521 ). Miền nội bào của EphrinB2 được phát hiện là rất quan trọng đối với việc tạo khuôn mạch bạch huyết ở chuột ( 646 ), cho thấy rằng ephrins cũng đại diện cho một dấu hiệu tạo khuôn được chia sẻ bởi cả hệ thống bạch huyết và vi mạch. EphrinB2 và phối tử EphB4 của nó là những chất điều hòa quan trọng đối với số phận tế bào động mạch và tĩnh mạch trong quá trình phát triển phôi thai ( 15 , 1121 ). Ở người trưởng thành, tín hiệu hai chiều có liên quan đến sự hướng dẫn của tế bào mạch máu và huy động các tế bào hỗ trợ quanh mạch máu, tuy nhiên vai trò của các phân tử này trong việc nhận dạng mạch máu vẫn chưa rõ ràng ( 343 ).
Giáo điều hiện tại ngụ ý rằng mạng lưới vi mạch bạch huyết và máu vẫn tách biệt ở người trưởng thành. Tuy nhiên, trong 15 năm qua, một số quan sát đã cung cấp bằng chứng về mối liên hệ trực tiếp giữa hai hệ thống này. Việc tiêm dextran hoặc BSI-lectin có nhãn FITC đã xác định được sự truyền máu đến bạch huyết ở chuột thiếu SLP-76 ( 4 ), Rac1 ( 226 ), O-glycan ( 355 ) hoặc Fiaf ( 58 ). Kết quả tương tự đã được ghi nhận ở chuột đột biến có điều kiện Prox1 ( 489 ). Ngay cả các kết nối mạch máu-bạch huyết trực tiếp ở cấp độ vi mạch cũng đã được phát hiện trong mạng lưới vi mạch mạc treo chuột trưởng thành ( 914 , 1020 , 1034 ). Về bằng chứng cho thấy các yếu tố môi trường địa phương có thể gây ra sự tưới máu bạch huyết, Jensen et al. đã chứng minh rằng oxit nitric và tình trạng thiếu oxy là đủ ( 229 ). Oxit nitric đã được chứng minh là cho phép tưới máu bạch huyết do thiếu oxy ở cá ngựa vằn tại các vị trí thông nối động mạch-bạch huyết ( 229 ). Những phát hiện của nghiên cứu cụ thể này cho thấy một dấu hiệu phân tử đủ để tạo ra độ dẫn giữa hệ thống vi mạch bạch huyết và máu. Việc sản xuất oxit nitric tăng lên cũng có liên quan trực tiếp đến di căn bạch huyết có liên quan đến oxit nitric như một chất trung gian đưa dòng tế bào vào mạch bạch huyết ( 573 ). Sự sai lệch về mặt giải phẫu giữa hai hệ thống cũng được ghi lại bằng nhiều báo cáo lịch sử hơn trong tài liệu. Ví dụ, các kết nối bạch huyết-tĩnh mạch ở mức mạch lớn bên ngoài điểm vào ống dưới đòn và ống ngực đã được báo cáo, đặc biệt trong các tình huống tăng áp lực do tắc mạch ( 694 , 1178 ). Thông nối bạch huyết-tĩnh mạch ở mức mạch lớn cũng được báo cáo ở tim 7 và 14 ngày sau khi tắc bạch huyết ( 304 ).
Nhận dạng kiểu hình tế bào nội mô cũng cung cấp một ví dụ về mối quan hệ qua lại giữa hệ thống máu và bạch huyết. Dán nhãn miễn dịch VEGFR3, LYVE1 và PECAM, cung cấp bằng chứng cho cả sự giống nhau và phân định các loại tế bào nội mô bạch huyết và máu ( 481 ). Trong quá trình phát triển, các tế bào nội mô bạch huyết bắt nguồn và nảy chồi từ hệ thống tĩnh mạch. Sự khác biệt về kiểu hình sau đó xuất hiện giữa các tế bào nội mô bạch huyết và tĩnh mạch trong các giai đoạn phát triển sau này, tuy nhiên những khác biệt này bị thách thức ở người trưởng thành trong một số tình huống bệnh lý nhất định. Ngay cả VEGFR3, một dấu hiệu rất phổ biến của các tế bào nội mô bạch huyết trong các mô trưởng thành không hoạt động, được biểu hiện dọc theo các mạch máu trong quá trình hình thành mạch máu bệnh lý ( 1148 ). Ngoài ra, dấu hiệu bạch huyết được chấp nhận rộng rãi là LYVE1 ở các mô trưởng thành lần đầu tiên được biểu hiện bằng một tập hợp con các tế bào nội mô tĩnh mạch tim liên quan đến sự nảy chồi ban đầu của bạch huyết ( 470 ) và ở người trưởng thành trở nên điều hòa xuống trong các mạch thu thập lớn hơn ( 646 ). Ngoài việc đánh dấu các tế bào nội mô bạch huyết, biểu hiện LYVE1 còn xác định các đại thực bào được kích hoạt trong các mô trưởng thành ( 262 , 775 ). Các đại thực bào gần đây thực sự được coi là chất điều hòa cận tiết của cả quá trình tạo mạch và tạo mạch bạch huyết ( 526 , 537 , 602 , 775 ). Sự trùng lặp về kiểu hình của chúng cũng làm nổi bật lĩnh vực nghiên cứu mới nổi tập trung vào dòng tế bào nội mô bạch huyết trong quá trình hình thành mạch bạch huyết ở mô trưởng thành và khả năng các đại thực bào hoặc tế bào tiền thân tuần hoàn biệt hóa thành cả tế bào máu và tế bào nội mô bạch huyết ( 204 , 303 , 411 , 658 , 829 , 844 ). Không còn nghi ngờ gì nữa, những tiến bộ trong hiểu biết của chúng ta về đại thực bào như một chất điều hòa tế bào và là nguồn tạo mạch và tạo mạch bạch huyết cho thấy tiềm năng cho những khám phá mới liên quan đến độ dẻo của tế bào nội mô và khả năng tạo ra kiểu hình tế bào nội mô bạch huyết của máu đối với tính dẻo, một khái niệm đã được chứng minh là có thể trong ống nghiệm ( 203 ).
Dòng chảy kẽ và sự hình thành bạch huyết
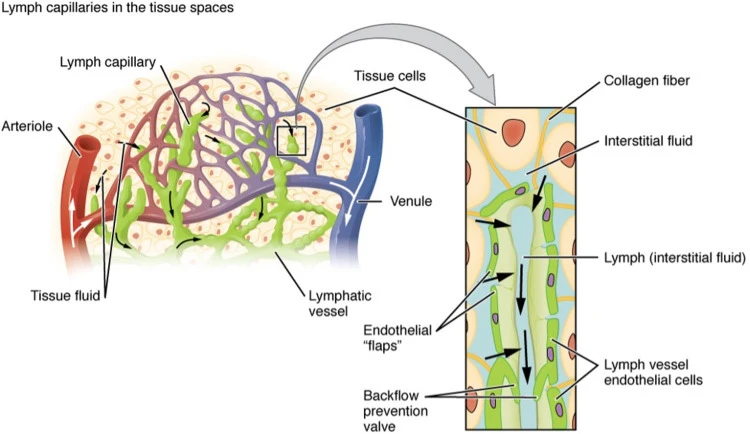
Hệ tuần hoàn khép kín của hệ thống tim mạch ở động vật có vú, để hoàn thành vai trò cung cấp chất lỏng và chất dinh dưỡng cho các mô, liên tục rò rỉ huyết tương. Sự rò rỉ này xảy ra trong hệ vi mạch, đặc biệt là từ các mao mạch và tĩnh mạch sau mao mạch. Đối với một người trung bình có thể tích huyết tương 3 L, khoảng 8 L huyết tương được lọc mỗi ngày bởi các vi mạch trao đổi này trên khắp cơ thể, nghĩa là toàn bộ thể tích huyết tương được lọc khoảng 9 giờ một lần ( 600 ).
Các mạch bạch huyết từ lâu đã được công nhận về vai trò của chúng trong cân bằng nội môi chất lỏng và đại phân tử, có tác dụng bảo vệ phần lớn các mô chống lại sự hình thành phù nề. Thực nghiệm làm suy giảm khả năng quay trở lại của bạch huyết (lỗ rò ống ngực) dẫn đến mất nước nghiêm trọng chỉ trong vòng vài ngày ( 983 ). Các mạch bạch huyết ban đầu đóng vai trò là điểm vào để chất lỏng này được đưa trở lại tuần hoàn trung tâm. Chức năng này rất quan trọng để duy trì đủ thể tích tuần hoàn trung tâm và cũng ngăn ngừa sưng mô, đảm bảo cân bằng nội môi của môi trường mô. Dự trữ sinh lý của mạch bạch huyết để loại bỏ huyết tương bị rò rỉ được ước tính cao gấp 10 lần so với lượng huyết tương bình thường rò rỉ từ vi tuần hoàn, thiết lập một giới hạn an toàn có thể bảo vệ chống lại sự hình thành phù nề trong thời kỳ tính thấm của vi mạch tăng cao. bởi các kích thích viêm ( 391 ). Do đó, đến một giới hạn nhất định được xác định bởi giới hạn an toàn, khi rò rỉ vi mạch tăng lên ở một vị trí cụ thể, lưu lượng bạch huyết từ vị trí đó cũng tăng lên.
Rò rỉ vi mạch
Sự rò rỉ huyết tương qua thành tĩnh mạch mao mạch và sau mao mạch tạo nên sự chênh lệch cho dòng chảy kẽ và sự hình thành bạch huyết ngoại biên. Sự rò rỉ vi mạch được xác định bởi tính thấm của mao mạch và tĩnh mạch sau mao mạch, và bởi sự mất cân bằng áp suất thủy tĩnh và áp suất thẩm thấu tổng thể, được gọi là phương trình Starling (Hình 26), qua nội mô của các mạch này ( 295 ).

Lực lượng Starling và rò rỉ vi mạch. Lực Starling bao gồm áp suất thủy tĩnh và áp suất thẩm thấu điều khiển dòng chất lỏng qua thành vi mạch. MỘT . Độ dốc áp suất thủy tĩnh thực, được xác định bằng áp suất thủy tĩnh mao mạch (P c ) trừ đi áp suất thủy tĩnh kẽ của mô xung quanh (P i ) tạo điều kiện cho dòng chất lỏng chảy ra khỏi mao mạch. Lưu ý rằng P c , được xác định bởi áp suất thủy tĩnh tĩnh mạch ngược dòng và tĩnh mạch hạ lưu, giảm dọc theo chiều dài của mao mạch khi di chuyển ra khỏi phía động mạch (trái) và tiến gần hơn đến phía tĩnh mạch (phải), trong khi pi . tương đương dọc theo toàn bộ chiều dài mao mạch. B. _ Áp suất thẩm thấu mao mạch (∏ c ) được xác định chủ yếu bởi protein huyết tương, trong khi áp suất thẩm thấu kẽ (∏ i ) được xác định bởi hàm lượng protein trong khoảng kẽ. Độ dốc áp suất thẩm thấu (hoặc keo), được xác định bởi sự chênh lệch giữa ∏ c và ∏ i , tạo điều kiện cho chất lỏng đi vào mao mạch và thường không đổi dọc theo chiều dài của mao mạch. C . Dòng dịch thực thu được khi xem xét cả gradient áp suất thủy tĩnh và áp suất thẩm thấu có lợi cho sự thoát mạch, mặc dù dòng dịch giảm dọc theo chiều dài mao mạch. D. _ Phương trình dòng điện được sử dụng để mô tả các lực này cũng bao gồm các yếu tố bổ sung, bao gồm độ dẫn thủy lực của nước (L p ), diện tích bề mặt trao đổi (S) và hệ số phản xạ của protein huyết tương (σ). Những yếu tố này tính đến những thay đổi có thể xảy ra do tăng lưu lượng máu và huy động mao mạch (ảnh hưởng đến S) và những thay đổi về tính toàn vẹn của thành vi mạch (ảnh hưởng đến L p và σ).
Cách đây vài năm, người ta đã chỉ ra rằng một vấn đề với nguyên lý Starling là giả định rằng vi mạch không cho protein huyết tương thấm vào, trong khi trên thực tế, các tĩnh mạch sau mao mạch đều cho phép rò rỉ protein huyết tương ( 423 ). Một số dữ liệu khác được tích lũy đã dẫn đến việc xem xét lại nguyên lý Starling ( 600 ). Chúng bao gồm các quan sát không tương thích hoặc làm phức tạp đáng kể khái niệm ban đầu: 1) Tăng thực nghiệm áp suất thẩm thấu mô (∏ t ) xung quanh mao mạch mạc treo ếch đến mức tương đương với áp suất thẩm thấu huyết tương (∏ p ) không gây ra thay đổi thực sự nào trong quá trình lọc ( 452 ); 2) Những thay đổi về dòng thể tích của chất lỏng (J v ) được biết là thay đổi ở ∏ t và áp suất thủy tĩnh của mô (P t ) ( 906 , 907 , 1055 ); 3) Các phát hiện từ các nghiên cứu thực nghiệm và lý thuyết hỗ trợ rằng chất lỏng dưới đường ngay bên ngoài hàng rào bán thấm có thành phần khác biệt đáng kể so với chất lỏng kẽ trong mô ( 16 , 453 , 598 , 687 , 1131 ); 3) dữ liệu thu được trong các nghiên cứu đánh giá tổng lực Starling không ủng hộ mô hình lọc/tái hấp thu truyền thống ( 71 , 599 , 1224 ); và 4) ở áp suất mao mạch dưới áp suất thẩm thấu huyết tương, sự hấp thụ chỉ được quan sát thoáng qua chứ không ở trạng thái ổn định ở mao mạch mạc treo hoặc sử dụng các lớp đơn lớp nội mô trong buồng Ussing ( 689 , 834 , 1214 ).
Trong mô hình sửa đổi, những thay đổi trong sự cân bằng của áp suất thủy tĩnh và áp suất thẩm thấu của lòng vi mạch và môi trường mô cục bộ có thể gây ra những thay đổi nhất thời về hướng chuyển động của chất lỏng. Tuy nhiên, trong điều kiện trạng thái ổn định, quá trình lọc thường được thực hiện xuyên suốt chiều dài của các mao mạch liên tục và các tiểu tĩnh mạch sau mao mạch ở hầu hết các mô. Các trường hợp ngoại lệ đáng chú ý bao gồm niêm mạc ruột, vỏ thận và tủy thận, tất cả đều có cơ chế vận chuyển biểu mô cục bộ ảnh hưởng đáng kể đến ∏ t và P t . Các chi tiết bổ sung có sẵn trong phần đánh giá nói trên ( 600 ). Một thông điệp rút ra từ nguyên tắc Starling sửa đổi là sự tái hấp thu chất lỏng vào mao mạch không có khả năng giải thích cho việc loại bỏ nhiều chất lỏng khỏi các khu vực kẽ. Bạch huyết chủ yếu thực hiện chức năng này.
Sự hấp thụ chất lỏng của ruột
Ở ruột non, sự hình thành bạch huyết cũng được thúc đẩy phần lớn bằng cách hấp thụ nước hoặc lipid ăn vào vào khoảng kẽ ( 1178 ). Trong khi tăng huyết áp chức năng cũng có thể làm tăng quá trình lọc huyết tương sau khi ăn, khi sử dụng một lượng lớn dịch nhược trương hoặc đẳng trương, lưu lượng bạch huyết tăng nhanh và một phần đáng kể dịch ăn vào xuất hiện trong bạch huyết ( 66 , 110 , 986 ). Ngoài ra, trong các thí nghiệm về lỗ rò ống ngực, dùng đường uống 0,6% hoặc 0,8% NaCl trong dung dịch glucose 5% làm tăng đáng kể lưu lượng bạch huyết trong ống ngực, so với dung dịch glucose 5% không có NaCl ( 376 ). Việc tiêu thụ carbohydrate và protein dường như không góp phần làm tăng lưu lượng bạch huyết ( 1178 ).
Sự hình thành dịch kẽ và bạch huyết
Dịch kẽ được tạo ra bằng cách lọc huyết tương vi mạch. Do các mô và cơ quan chiếm không gian hạn chế nên sự tích tụ dịch kẽ tạo ra áp lực và đóng vai trò là động lực hình thành bạch huyết. Hệ bạch huyết ban đầu thường nằm ở khá gần các mao mạch và tĩnh mạch sau mao mạch, thường trong phạm vi hàng trăm μm ( 964 ), do đó chênh lệch áp suất trong các mô được thiết lập, tạo điều kiện thuận lợi cho sự di chuyển của dịch kẽ từ các vị trí rò rỉ vi mạch về phía hệ bạch huyết ban đầu ( 89 , 400 , 441 , 1213 ). Các con đường tiền bạch huyết khác nhau trong kẽ hình thành các đường dẫn chất lỏng dọc theo các sợi mô liên kết, xuyên qua các khoảng trống và trong một số trường hợp trong các kênh tiền bạch huyết dài hơn ( 422 ). Chi tiết kỹ lưỡng về cơ chế vật lý và hóa học chi phối dòng chảy kẽ được cung cấp trong một bài đánh giá gần đây ( 1143 ).
Schmid-Schönbein đã chỉ ra rằng ở áp suất điển hình gặp phải trong cơ thể , chất lỏng không thể nén được, dẫn đến hai nguyên tắc chung: 1) Sự thay đổi thể tích mô bị ảnh hưởng trực tiếp bởi lượng chất lỏng đi vào và rời khỏi mô tại bất kỳ thời điểm nào. Nếu mô bị nén, do chất lỏng không thể nén được nên ít chất lỏng phải vào mô hoặc nhiều chất lỏng phải thoát ra ngoài, hoặc kết hợp cả hai; và 2) Nếu một cơ quan duy trì thể tích không đổi, thì nếu một bộ phận của cơ quan đó nở ra, thì các bộ phận khác của cơ quan đó sẽ bị nén ở mức độ tương đương ( 964 ). Theo những nguyên tắc này, trong các mô khỏe mạnh không có chức năng hấp thụ hoặc bài tiết và không bị phù nề, sự hình thành bạch huyết xảy ra với tốc độ tương tự như sự rò rỉ chất lỏng từ vi tuần hoàn. Thí nghiệm truyền nước muối vào tĩnh mạch, gây ra hiện tượng pha loãng máu, tăng lọc trong vi tuần hoàn và tăng dần áp lực kẽ theo thời gian ( 1141 ), làm tăng lưu lượng bạch huyết rõ ràng trong việc thu thập bạch huyết ( 82 , 880 ). Như đã nêu ở trên, tốc độ tối đa mà dịch kẽ có thể được loại bỏ khỏi mô (tức là tốc độ tối đa mà bạch huyết mới có thể được hình thành), xác định giới hạn an toàn để bảo vệ chống lại sự hình thành phù nề ( 391 ). Khi xem xét điều này, cùng với nguyên tắc Starling đã được sửa đổi, tất cả các dạng phù nề đều có thể liên quan đến việc thoát bạch huyết không đủ ( 730 ).
Các lực ảnh hưởng đến sự chuyển động của dịch kẽ rất năng động và bị ảnh hưởng mạnh mẽ bởi sự chuyển động của mô và sự thay đổi lưu lượng máu cục bộ. Cách đây vài thập kỷ, Guyton đã đo áp suất dịch kẽ bằng cách sử dụng các viên nang đục lỗ được cấy vào các mô khác nhau của chó trong tối đa 4 tuần. Công trình của ông cho thấy giá trị áp suất dưới khí quyển ở các mô bình thường, nhưng áp suất dương ở các mô phù nề ( 399 ). Khái niệm về áp suất trung bình dưới khí quyển, kết hợp với những phát hiện sau này về áp suất chất lỏng trong lòng mạch bạch huyết cao hơn một chút so với áp suất khí quyển đã tạo ra một nghịch lý về việc làm thế nào chất lỏng kẽ có thể trở thành bạch huyết khi có một gradient áp suất dốc lên ( 415 , 1010 , 1223 , 1225 ).
Để trả lời câu hỏi này, bản chất của việc vận chuyển dịch kẽ từ vi tuần hoàn đến hệ bạch huyết ban đầu phải được xem xét. Một khả năng có thể là cơ chế dòng chảy ổn định không yêu cầu nén hoặc giãn các mô và trong đó chất lỏng sẽ di chuyển với tốc độ không đổi qua khoảng kẽ. Với áp lực dịch kẽ âm trung bình và áp lực dương trong lòng mạch bạch huyết, cơ chế dòng chảy ổn định của sự hình thành bạch huyết là không thể xảy ra và bằng chứng chưa được tích lũy để hỗ trợ khả năng này. Tuy nhiên, nếu có sự nén hoặc giãn nở định kỳ của các mô, điều này có thể tạo ra sự vận chuyển chất lỏng không ổn định và đã có nhiều bằng chứng ủng hộ điều này ( 964 , 1201 ). Một vấn đề cần cân nhắc khác là sự đóng góp tương đối của chênh lệch áp suất thẩm thấu và áp suất thủy tĩnh trong việc di chuyển dịch kẽ qua thành bạch huyết ban đầu. Một giả thuyết ban đầu cho rằng bạch huyết mới hình thành có thể tạo ra các gradient thẩm thấu theo chu kỳ tạo điều kiện cho sự hình thành bạch huyết bổ sung và khắc phục chênh lệch áp suất thủy tĩnh ( 162 , 964 , 1143 , 1201 ). Tuy nhiên, phân tích tiếp theo về nồng độ protein trong bạch huyết từ bạch huyết ban đầu và thu thập không ủng hộ giả thuyết này ( 1198 ).
Một giả thuyết bổ sung có nhiều khả năng đúng hơn là áp suất thủy tĩnh trong mô dao động, đặc biệt là ở các cơ quan có chuyển động dao động như tim hoặc phổi, và những thay đổi nhất thời về áp suất thủy tĩnh này tạo ra dòng chảy không ổn định của dịch kẽ vào các mạch bạch huyết ban đầu. ( 964 , 1201 ). Ví dụ, sự co và giãn của cơ hoành khi hít vào và thở ra, tương ứng, sẽ kéo giãn mạng lưới bạch huyết màng phổi một cách tối ưu, giữ cho áp suất dịch trong bạch huyết luôn thấp hơn áp suất dịch màng phổi trong suốt chu kỳ thở ( 395 , 700 , 701 , 720 – 722 , 755 , 761 ). Đáng chú ý, trong quá trình phổi chuột bị tê liệt và thở máy, áp lực trong bạch huyết không giảm đáng kể như khi hít vào tự phát, cho thấy tầm quan trọng của các cơn co thắt cơ hoành trong việc thiết lập các gradient thuận lợi cho sự hình thành bạch huyết từ khoang màng phổi ( 722 ). Điều thú vị là, các lực truyền qua lồng ngực do chu kỳ tim cũng góp phần vào sự chênh lệch áp lực xuyên thành tổng thể tạo điều kiện thuận lợi cho sự hình thành bạch huyết trong bạch huyết màng phổi từ dịch màng phổi, được tiết lộ từ các nghiên cứu bao gồm đo đồng thời áp lực kẽ và áp lực trong bạch huyết ( 722 , 760 ). Có một số ví dụ khác về sự chuyển động của mô góp phần vào dòng bạch huyết. Di chuyển chân tay, đi bộ hoặc xoa bóp da nhẹ nhàng cũng thúc đẩy sự hình thành bạch huyết ( 469 , 670 , 805 , 812 ), Trong ruột, cả chuyển động của các lớp cơ trơn bên ngoài và sự co bóp của nhung mao được kích thích trong quá trình hấp thụ chất lỏng đều có tương quan với việc tăng lưu lượng bạch huyết ( 1151 ).
Liệu giả thuyết thủy tĩnh có áp dụng được cho các mô ở trạng thái nghỉ không? Khái niệm cho rằng trường hợp này có thể xảy ra ban đầu được đưa ra dựa trên các quan sát ở tai thỏ, trong đó việc loại bỏ bạch huyết của các hạt đánh dấu được tiêm dưới da cần có các xung động mạch cục bộ ( 679 , 847 ). Sự tưới máu ổn định của các tiểu động mạch dẫn đến phù nề, trong khi dòng chảy theo nhịp (không ổn định) thúc đẩy quá trình làm sạch bạch huyết của dịch kẽ ( 679 ) . Sau đó, người ta chứng minh rằng nhịp đập của động mạch được truyền đến các mạch bạch huyết ( 211 , 1126 ), điều này có thể hình dung được có thể tạo ra các gradient áp lực nhất thời thúc đẩy các gợn sóng chuyển động của chất lỏng qua không gian kẽ về phía bạch huyết ban đầu. Những thay đổi theo chu kỳ trong gradient áp suất trên thực tế sau đó đã được chứng minh ở cánh dơi, mặc dù hệ bạch huyết ban đầu của cánh dơi không điển hình vì chúng là những củ lớn với lớp cơ trơn co rút theo từng giai đoạn ( 440 , 441 ). Mặc dù kết quả từ ít nhất một nghiên cứu ở chân sau của cừu cho thấy rằng cơ chế chênh lệch áp suất do nhịp đập của động mạch không thúc đẩy sự hình thành bạch huyết ( 669 ), phần lớn dữ liệu tại thời điểm này cung cấp bằng chứng cho thấy trong các mô ở trạng thái nghỉ, có độ dốc thủy tĩnh nhất thời. có thể tạo điều kiện thuận lợi cho dòng chất lỏng kẽ và hình thành bạch huyết.
Sự xâm nhập của chất lỏng vào hệ bạch huyết ban đầu
Các tế bào nội mô tạo nên thành của bạch huyết ban đầu tạo thành một hàng rào bán thấm tạo điều kiện cho dịch kẽ dư thừa xâm nhập vào lòng bạch huyết, đồng thời ngăn chặn sự thoát ra của bạch huyết mới hình thành này khi áp suất thủy tĩnh trong lòng vượt quá áp suất kẽ. Các van bạch huyết chính, còn được gọi là nút nối, (Hình 3B) có vai trò quan trọng trong việc cho phép dịch cạnh tế bào di chuyển một chiều vào lòng bạch huyết ( 69 , 77 , 107 , 117 ). Các van hoặc lá van này được hình thành bởi cấu trúc nối độc đáo của các tế bào nội mô bạch huyết ban đầu hình lá sồi, với các mẫu dán nhãn VE-cadherin và PECAM-1 xen kẽ ( 5 , 81 ). Cấu trúc vạt tương tự cũng đã được mô tả ở đầu các tuyến bạch huyết ( 792 ), mặc dù dữ liệu từ ít nhất một nghiên cứu cho thấy rằng các cấu trúc này có thể giống các lỗ hơn là van một chiều ( 594 ).
Các lá van một chiều chính được cho là cho phép chất lỏng đi vào do dao động thủy tĩnh trong áp suất chất lỏng kẽ. Khi áp suất kẽ vượt quá áp lực của lòng bạch huyết, các van sẽ mở ra để cho chất lỏng đi vào. Tuy nhiên, khi áp suất trong lòng van vượt quá áp suất kẽ, các lá van này buộc phải đóng lại. Ngoài các van sơ cấp, các sợi neo bám từ các tế bào nội mô bạch huyết ban đầu vào khoảng kẽ được cho là giúp duy trì sự thông thoáng của lòng bạch huyết ban đầu ( 69 , 117 ).
Ngoài các khía cạnh khuếch tán và đối lưu thụ động của quá trình vận chuyển, các tế bào nội mô bạch huyết còn có khả năng chủ động thay đổi hình dạng và tính chất rào cản của các điểm nối của chúng để đáp ứng với các kích thích vật lý hoặc hóa học. Dòng chảy xuyên qua các tế bào nội mô bạch huyết hoạt động như một tín hiệu để điều chỉnh tăng biểu hiện aquaporin-2, bài tiết CCL21, tái tổ chức VE-cadherin và định vị PECAM-1, tăng tính thấm và di chuyển tế bào đuôi gai vào bạch huyết ( 704 ). Ngược lại, dòng chảy dịch cắt tăng cao trên bề mặt đỉnh của các đơn lớp tế bào nội mô bạch huyết nuôi cấy giúp tăng cường chức năng rào cản ( 129 ). Một số kích thích hóa học, bao gồm các cytokine gây viêm và các chất trung gian TNF-a, IL-6, IL-1β, IFN-γ, histamine và trombin, nội độc tố của vi khuẩn và yếu tố tăng trưởng VEGF-C đã được chứng minh là phá vỡ tính toàn vẹn của hàng rào nuôi cấy. tế bào nội mô bạch huyết ( 127 , 130 , 213 ). Tính thấm tăng cao của các đơn lớp nội mô bạch huyết đi kèm với quá trình phosphoryl hóa chuỗi nhẹ myosin, kích hoạt khung tế bào và giảm biểu hiện VE-cadherin, tất cả đều có thể được ngăn chặn bằng cách phong tỏa NO synthase về mặt dược lý ( 213 ). Các cơ chế như vậy có thể giải thích một phần cho việc mở các mối nối nội mô bạch huyết và tăng lưu lượng bạch huyết được báo cáo trước đây có liên quan đến chấn thương ( 157 ).
Đóng góp của cơ chế vận chuyển xuyên tế bào vào sự hình thành bạch huyết
Ngoài khả năng thẩm thấu khuếch tán của chất lỏng và chất hòa tan vào hệ bạch huyết ban đầu, còn có bằng chứng về sự vận chuyển tích cực qua các tế bào nội mô bạch huyết. Các túi vận chuyển từ lâu đã được coi là cơ chế vận chuyển qua nội mô ( 273 , 274 , 584 ). Điều đáng chú ý là đã có tranh luận trong nhiều thập kỷ về cơ chế hấp thu chylomicron vào tế bào và tế bào trong nhiều thập kỷ ( 265 ). Ví dụ, ảnh chụp vi điện tử cho thấy chylomicron ở cả không gian nối giữa các tế bào nội mô bạch huyết liền kề của tuyến sữa và trong các túi bên trong nội mô bạch huyết ( 157 , 161 , 198 , 352 , 572 , 833 , 842 , 925 , 942 , 1089 ).
Một mối quan tâm tiềm tàng với những nghiên cứu này là khả năng gây tổn thương cho các mô trong quá trình cố định và cắt ( 55 , 273 ). Cân nhắc điều này, những người khác đã báo cáo rằng việc mở các mối nối giữa các tế bào nội mô của tuyến bạch huyết nói chung là hiếm, ngay cả khi tuyến sữa bị căng phồng quá mức do chất lỏng ( 51 , 52 , 274 , 1075 ). Dobbins và các đồng nghiệp đã trình bày trường hợp vận chuyển các túi trong tế bào nội mô, chiếm 15% thể tích tế bào chất, có khả năng chiếm phần lớn sự xâm nhập chylomicron vào sữa ( 273 , 274 , 1075 ). Khái niệm vận chuyển tích cực cũng được hỗ trợ bởi bằng chứng về sự hấp thu có chọn lọc chylomicron dựa trên thành phần của chúng. Chuột thiếu gen ademona đa hình thái giống2 (chuột Plag2 -/− ) chết vì suy nhược sau sinh (về cơ bản là đói) do khả năng hấp thụ chylomicron vào bạch huyết kém. Các chylomicron ở chuột Plag2 -/− dường như thiếu những biến đổi cần thiết để hấp thu vào sữa ( 1102 ). Abetalipoproteinemia, sự vắng mặt thực sự của Apolipoprotein B (ApoB) trong bạch huyết (và cả huyết tương), cũng là do sự bất thường trong quá trình lắp ráp lipoprotein do đột biến lặn ở protein chuyển triglycerid của microsome (MTP) ( 319 , 394 ). Gần đây cũng có bằng chứng chức năng hỗ trợ việc vận chuyển tích cực chylomicron, từ hệ thống đồng nuôi cấy với tế bào Caco-2 và các lớp đơn tế bào nội mô bạch huyết ở da người ( 268 ). Trong hệ thống này, được thiết kế như một mô hình vận chuyển chất dinh dưỡng qua tế bào ruột và thành sữa, vận chuyển lipid nhanh hơn dextran hoặc albumin. Ngoài ra, có rất nhiều túi chứa lipid dường như di chuyển qua các tế bào nội mô, và sự vận chuyển chylomicron từ đáy đến đỉnh được ưa chuộng, hỗ trợ cho việc vận chuyển tích cực có thể góp phần hình thành bạch huyết ( 268 ). Quá trình vận chuyển này diễn ra khi ATP bị ức chế bởi natri azide ( 896 ). Sự hấp thu có chọn lọc của albumin có nhãn huỳnh quang được tiêm dưới da vào các tế bào nội mô bạch huyết ở da cũng đã được báo cáo. Trong các tế bào nội mô bạch huyết được nuôi cấy, quá trình này liên quan đến sự hấp thu vào các túi Caveolin-1+ và clathrin+ và bị suy giảm do ức chế thuốc nổ ( 1079 ).
Sự xâm nhập của tế bào qua nội mô bạch huyết
Các tế bào được tìm thấy trong mạch bạch huyết bao gồm hầu hết các tế bào miễn dịch, bao gồm tế bào lympho T và B, bạch cầu đơn nhân, đại thực bào và tế bào đuôi gai, và một số bạch cầu trung tính và bạch cầu ái toan. Trong một số trường hợp, hồng cầu cũng được phát hiện và trong quá trình đáp ứng miễn dịch, có sự hiện diện của các nguyên bào lympho B (tế bào plasma) tiết kháng thể được kích hoạt. Các tế bào khối u cũng có thể xâm nhập vào hệ bạch huyết. Các tế bào miễn dịch xâm nhập vào cả hệ bạch huyết ban đầu và các hạch bạch huyết ( 809 ). Hệ bạch huyết ban đầu đóng vai trò là nơi xâm nhập vào bạch huyết hướng tâm cho các tế bào T nhớ và tế bào đuôi gai CD11c hi MHC II + thông thường , và ở mức độ thấp hơn là các bạch cầu đơn nhân và đại thực bào từ các mô ngoại biên trong điều kiện trạng thái ổn định, không bị viêm ( 487 , 808 , 883 ). Trong các hạch bạch huyết, các tế bào miễn dịch có thể thoát khỏi vòng tuần hoàn máu thông qua các tĩnh mạch nội mô cao (HEV). Các tế bào đi vào hạch bạch huyết bằng con đường này bao gồm tế bào đuôi gai CD11c lo MCH II + plasmacytoid và tế bào lympho T và B ngây thơ ( 53 ). Các quần thể tế bào riêng biệt xâm nhập vào hệ bạch huyết ở các hạch bạch huyết và bạch huyết ban đầu làm cho thành phần tế bào của bạch huyết hướng tâm khác với thành phần của bạch huyết ly tâm. Thành phần của tế bào bạch huyết cũng phụ thuộc vào sự hiện diện của kháng nguyên và tình trạng viêm.
Thụ thể CC-chemokine-7 (CCR7) điều chỉnh sự di chuyển của các tế bào miễn dịch để đáp ứng với các chemokine CCL19 và CCL21. CCR7 được biểu hiện bởi các tế bào tuyến ức trong các giai đoạn phát triển xác định, các tế bào T và B ngây thơ, một quần thể tế bào T bộ nhớ được gọi là tế bào T bộ nhớ trung tâm (T CM ), tế bào T Reg , tế bào đuôi gai bán trưởng thành và trưởng thành, và một quần thể tế bào đuôi gai bán trưởng thành và trưởng thành. bạch cầu trung tính ( 74 , 344 ). Mức độ biểu hiện tăng lên ở tế bào đuôi gai hoặc tế bào B sau khi kích hoạt, tạo điều kiện di chuyển đến các khu vực tế bào T trong hạch bạch huyết ( 344 ). CCR7 cũng được biểu hiện bởi một số tế bào không miễn dịch, trong đó đáng chú ý nhất là một số loại tế bào khối u ác tính ( 977 ). Những con chuột thiếu CCR7 có phản ứng miễn dịch yếu hoặc chậm và phát triển khả năng tự miễn dịch do sự di chuyển bình thường của các tế bào đuôi gai, tế bào T và tế bào B bị suy giảm và môi trường vi mô chức năng bình thường của các hạch bạch huyết bị phá vỡ ( 240 , 241 , 345 , 566 ).
CCR7 có hai phối tử đã biết là chemokine CCL19 và CCL21 ( 345 ). Các tế bào biểu hiện CCR7 di chuyển có hướng về phía CCL19 và CCL21 ( 344 ). Cả CCL19 và CCL21 đều được sản xuất bởi các tế bào lưới nguyên bào sợi ở vùng giàu tế bào T của các hạch bạch huyết ( 612 , 632 , 763 , 1144 ). Ngoài ra, CCL21 còn được sản xuất bởi các tế bào nội mô của HEV và tế bào nội mô của hệ bạch huyết ban đầu ( 344 , 396 , 558 ). Các tế bào nội mô bạch huyết ban đầu cấu thành biểu hiện CCL21, nhưng biểu hiện cũng có thể được điều chỉnh tăng lên nhờ sự hiện diện của tế bào đuôi gai hoặc TNF-α ( 488 , 656 ). Trên các mạch bạch huyết ban đầu, có thể quan sát thấy các mảng CCL21 cố định rời rạc trên các tế bào nội mô ( 488 , 1050 ). Những miếng vá này nằm gần nhưng không phải là một phần của các lá van chính (Hình 27). Chức năng của chúng dường như là sự phối hợp gắn các tế bào đuôi gai và các tế bào biểu hiện CCR7 khác vào nội mô bạch huyết ( 1050 ).

Sự lắng đọng CCL21 nằm ở các vùng cụ thể của tế bào nội mô bạch huyết ban đầu. MỘT . Kết xuất hình ảnh đồng tâm về ghi nhãn ba lần cho Lyve1, CCL-21 và VE-cadherin của bạch huyết ban đầu ở tai chuột cho thấy các vị trí lắng đọng CCL21 khác biệt. Bảng B hiển thị một cái nhìn gần hơn. Sao chép từ tài liệu tham khảo ( 1050 ) với sự cho phép.
Tế bào đuôi gai
Tế bào đuôi gai là những tế bào thực bào, có tính di động cao, có vai trò quan trọng trong cả khả năng miễn dịch bẩm sinh và là tế bào trình diện kháng nguyên trong khả năng miễn dịch thích nghi. Chúng cũng là loại tế bào trình diện kháng nguyên chính được tìm thấy trong bạch huyết hướng tâm, mặc dù rất ít tế bào xâm nhập vào bạch huyết ly tâm ( 637 , 871 , 883 , 1026 ). Các tế bào đuôi gai phát sinh từ quá trình tạo máu trong tủy xương, ban đầu là các tế bào chưa trưởng thành liên tục lấy mẫu mầm bệnh, với các quần thể đa dạng cư trú trong các mô hoặc được tuyển dụng từ máu ( 883 ). Trong điều kiện không viêm, số lượng tế bào đuôi gai tương đối thấp nhưng ổn định xâm nhập vào bạch huyết hướng tâm. Sự xâm nhập ở trạng thái ổn định này dường như có vai trò trong việc phát triển và duy trì khả năng dung nạp miễn dịch đối với các kháng nguyên tự thân ( 789 ). Các tín hiệu viêm làm cho số lượng tế bào đuôi gai trong bạch huyết hướng tâm tăng lên theo một mức độ lớn. Sự gia tăng do viêm gây ra này liên quan đến cả việc kích hoạt các tế bào đuôi gai và nội mô bạch huyết để điều phối sự xâm nhập của tế bào đuôi gai vào bạch huyết ( 471 , 639 , 656 ).
Các tế bào đuôi gai được kích hoạt và trưởng thành sau quá trình thực bào của mầm bệnh. Điều này liên quan đến sự phân hủy các protein gây bệnh thành các kháng nguyên có thể xuất hiện, sự trình diện kháng nguyên phụ thuộc MHC trên màng huyết tương và điều hòa lại CCR7 và các đồng thụ thể để kích hoạt tế bào T ( 656 ). Để đến được các hạch bạch huyết giàu tế bào T, các tế bào đuôi gai phải di chuyển từ các mô ngoại vi vào hệ bạch huyết đang dẫn lưu. Fascin protein bó sợi Actin, rất quan trọng cho sự hình thành và di chuyển của filopodia, trở nên được điều hòa trong các tế bào đuôi gai trưởng thành ( 565 , 920 , 1122 ). Như đã đề cập ở trên, độ dốc hấp dẫn của phối tử CCR7, CCL21, được tạo ra bởi các tế bào nội mô bạch huyết giàu podoplanin là một yếu tố chính. Điều này được chứng minh bằng sự di chuyển tế bào đuôi gai khiếm khuyết đến các hạch bạch huyết ở chuột thiếu CCR7 ( 345 , 789 ), sự di chuyển suy yếu của các tế bào đuôi gai thiếu CCR7 được chuyển tiếp vào vật chủ CCR7+ bình thường ( 656 ) và quan sát thấy các tế bào đuôi gai được tiêm vào lòng bàn chân của chuột không tích tụ trong các hạch bạch huyết khi dùng đồng thời với kháng thể trung hòa CCL21 ( 948 ). Sự di chuyển theo hướng qua trung gian CCR7 của các tế bào đuôi gai đã hoạt hóa qua kẽ được cho là theo kiểu amip, không phụ thuộc vào độ bám dính, tự chủ khỏi bối cảnh mô, cho phép chuyển nhanh đến hệ bạch huyết, dựa trên kết quả từ các nghiên cứu sử dụng gradient CCL19 ( 576 ) . Độ dốc khoảng cách xa của CCL21 trong các mô cũng được thiết lập do nó cố định trên heparan sulfate, gây khó khăn cho việc rửa trôi ( 1129 ). Các tế bào đuôi gai được kích hoạt cũng đã được báo cáo là tiết ra CCL19 ( 344 , 949 ), có thể hoạt động theo kiểu tự tiết hoặc thúc đẩy việc tuyển dụng các tế bào bổ sung để di chuyển về phía bạch huyết ban đầu. Một yếu tố quan trọng khác là các kích thích gây viêm, chẳng hạn như cysteinyl leukotrienes và prostaglandin E, làm nhạy cảm CCR7 với CCL19 và CCL21 ( 887 ). Exoenzym CD38, một ADP-ribosyl cyclase, dường như cũng làm nhạy cảm CCR7 với CCL19 và CCL21 ( 849 ). Các chất trung gian gây viêm như TNF-α và IL-1β cũng kích thích sản xuất chemokine và thụ thể chemokine để huy động và điều khiển các tế bào đuôi gai ( 310 ). Interferon loại I cũng thúc đẩy sự di chuyển và liên kết với các tế bào nội mô bạch huyết ( 922 ).
Khi đến nội mô bạch huyết ban đầu, các tế bào đuôi gai (và các loại tế bào khác xâm nhập vào đây) gặp một màng đáy không liên tục chứa collagen IV, laminin, perlecan và nidogen. Các tế bào đuôi gai có thể đi qua các khe giữa các nút nối (đường vào tế bào) hoặc qua các lỗ trong tế bào chất của tế bào nội mô (đường vào xuyên tế bào). Microvilli kéo dài từ các tế bào nội mô có chứa các phân tử bám dính bổ sung và các mảng CCL21 có thể tạo điều kiện thuận lợi cho việc gắn và di chuyển qua nội mô vào lòng bạch huyết ban đầu ( 488 , 1050 ). Người ta đã quan sát thấy các tế bào đuôi gai tham gia vào một quá trình độc lập với integrin trong điều kiện không viêm ( 576 , 861 ). Tuy nhiên, trong điều kiện viêm, các tế bào đuôi gai biểu hiện phối tử integrin ICAM-1, và ở mức độ thấp hơn, VCAM-1 trên bề mặt của chúng và liên kết với β-integrins trên các tế bào nội mô bạch huyết ( 486 , 1058 , 1066 ). Ngoài ra, CCL21 do LEC phát hành cũng tạo ra hoạt tính α 1 β 2 (LFA-1) trên tế bào đuôi gai của con người ( 300 ). Một số bằng chứng khác ủng hộ vai trò quan trọng của ICAM-1 và LFA-1 trong quá trình này: chuột thiếu ICAM-1 cho thấy việc tuyển dụng các tế bào đuôi gai vào các hạch bạch huyết bị khiếm khuyết ( 998 , 1159 ). Sự di chuyển tế bào đuôi gai đến các hạch bạch huyết cũng bị ức chế khi ICAM-1 bị chặn bằng kháng thể đặc hiệu ( 636 ). Các tế bào đuôi gai thiếu integrin β 2 cũng bị suy giảm khả năng di chuyển ( 1159 ) và sự di chuyển bị ức chế bởi các kháng thể kháng LFA-1 ( 636 , 922 ). Sự phong tỏa kết hợp của cả ICAM-1 và LFA-1 với các kháng thể đã ngăn chặn hoàn toàn sự di chuyển của tế bào đuôi gai đến các hạch bạch huyết ( 636 ).
Những thay đổi bổ sung do chemokine gây ra trong hình dạng tế bào đuôi gai tạo điều kiện thuận lợi cho việc đi qua nội mô bạch huyết ban đầu ( 27 , 487 , 883 ). Những thay đổi không do myosin II điều khiển ở cơ trong khung tế bào đuôi gai đóng vai trò then chốt trong việc tạo ra những thay đổi về hình dạng tế bào để đi qua những khoảng trống hẹp giữa các tế bào nội mô bạch huyết ban đầu hoặc qua các lỗ xuyên tế bào ( 576 ). Gần đây, thụ thể semaphorin plexin-A1 đã được chứng minh là rất quan trọng trong việc xâm nhập tế bào đuôi gai vào hệ bạch huyết ban đầu bằng cách kích hoạt quá trình này. Sema-3A được tạo ra bởi các mạch bạch huyết có chức năng như phối tử cho các thụ thể plexin A1-Neuropilin 1 (Nrp1) trên các tế bào đuôi gai ( 1048 ). Kích hoạt plexin A1-Nrp1 bằng Sema-3A làm tăng quá trình phosphoryl hóa chuỗi nhẹ myosin (MLC), thúc đẩy sự co bóp của Actomyosin và điều phối những thay đổi hình dạng cần thiết trong các tế bào đuôi gai để chui qua các khoảng trống hoặc lỗ chân lông hẹp trong nội mô bạch huyết ( 1048 ).
Sau khi xâm nhập vào hệ bạch huyết, các tế bào đuôi gai sẽ vận chuyển hàng hóa kháng nguyên của chúng khi chúng được vận chuyển trong bạch huyết hướng tâm tới các hạch bạch huyết ( 883 ). Trong hệ bạch huyết ban đầu, đã có báo cáo về sự di chuyển của các tế bào đuôi gai trên nội mô, theo hướng dòng chảy ( 768 , 1050 ). Khi đến các mạch bạch huyết thu thập, các tế bào đuôi gai được dòng bạch huyết vận tốc cao hơn mang đi trên đường đến các hạch bạch huyết ( 1050 ).
Tế bào lympho
Tế bào T trí nhớ cũng đi vào hệ bạch huyết ban đầu ( 487 , 883 ). Ở bạch huyết chuột, con đường xâm nhập của tế bào lympho T được mô tả là cạnh tế bào, trong khi các tế bào khác như đại thực bào được quan sát thấy đi qua các lỗ của tế bào chất ( 49 ). Các tế bào bộ nhớ thường trú trong mô thiếu CCR7, nhưng các tế bào T bộ nhớ di chuyển biểu hiện CCR7 và đi vào các mạch bạch huyết ban đầu, theo độ dốc CCL21 ( 138 , 253 , 1153 ). Sự xâm nhập của tế bào T vào hệ bạch huyết hướng tâm được điều hòa bởi lipid hoạt tính sinh học sphingosine-1-phosphate (S1P), chất này kích hoạt các thụ thể S1P cụ thể trên tế bào lympho T để di chuyển trực tiếp ( 590 ). S1P có thể đối kháng với sự di chuyển của tế bào T qua trung gian CCL21-CCR7 trong quá trình thử thách miễn dịch, giữ các tế bào T ở ngoại vi cho đến khi tình trạng viêm giải quyết ( 487 ).
Có ít tế bào lympho B hơn tế bào lympho T hiện diện ở cả bạch huyết hướng tâm và ly tâm ( 809 ). Ở các hạch bạch huyết ở cừu trưởng thành, bạch huyết hướng tâm thường cung cấp 2–5 triệu tế bào mỗi giờ, bao gồm khoảng 85% tế bào T, 5% tế bào B và 10% tế bào đuôi gai. Bạch huyết đi ra của hạch bạch huyết ở trạng thái nghỉ chứa số lượng tế bào gấp 10 lần bạch huyết hướng tâm (20–50 triệu mỗi giờ), với khoảng 75% tế bào T và 25% tế bào B ( 405 ). Sau khi được kích thích, số lượng tế bào trong bạch huyết hướng tâm tăng gấp đôi, với nhiều tế bào đuôi gai và tế bào T chuyển dạng vụ nổ hơn. Bạch huyết đi ra từ một hạch bạch huyết được kích hoạt chứa 100–500 triệu tế bào mỗi giờ, với cả tế bào T biến đổi vụ nổ và tế bào plasma tạo ra lượng kháng thể cao ( 405 ). Số lượng tế bào plasma tối đa (15–30% tổng số tế bào trong bạch huyết ly tâm) xuất hiện rõ ràng sau 80–120 giờ sau khi bắt đầu phản ứng miễn dịch ( 409 ).
Bạch cầu trung tính
Khi bắt đầu bị thương hoặc nhiễm trùng, bạch cầu trung tính là quần thể bạch cầu đầu tiên thoát ra khỏi tuần hoàn. Trong khi theo truyền thống được cho là có vai trò giới hạn ở khả năng miễn dịch bẩm sinh, bạch cầu trung tính gần đây đã cho thấy khả năng bắt giữ các kháng nguyên và di chuyển đến các hạch bạch huyết, trình diện kháng nguyên theo cách phụ thuộc MHC-II và kích hoạt tế bào T ( 3 , 189 , 219 , 456 , 457 , 647 ). Ở những con chuột được tiêm chủng Myobacteria Bovis trực khuẩn Calmette-Guérin (BCG), loại vắc-xin duy nhất hiện có hiệu quả chống lại bệnh lao, bạch cầu trung tính nhanh chóng được tuyển dụng tại vị trí tiêm chủng. Tuy nhiên, bạch cầu trung tính chứa vi khuẩn cũng được tìm thấy trong các hạch bạch huyết đang chảy nước ( 3 ).
Đối với bạch cầu trung tính, đường đến các hạch bạch huyết có thể thông qua các mạch bạch huyết hướng tâm hoặc bằng cách di chuyển qua các tĩnh mạch nội mô cao. Một số phối tử cho sự di chuyển dường như được chia sẻ, chẳng hạn như các integrin LFA-1, đại thực bào-1 AG và CXCR-4, trong khi L-selectin và P-selectin glycoprotein ligand-1 đặc hiệu cho sự di chuyển qua các tiểu tĩnh mạch nội mô cao ( 386 ). Để xâm nhập vào hệ bạch huyết, bằng chứng gần đây cho thấy rằng một tập hợp con bạch cầu trung tính biểu hiện CCR7 ( 74 ). integrin bạch cầu trung tính β2 dường như cũng là một phối tử quan trọng để xâm nhập vào hệ bạch huyết. Các kháng thể ngăn chặn integrin β 2 đã ngăn chặn >80% sự di chuyển bạch cầu trung tính đến các hạch bạch huyết ở chuột phóng viên GFP lysM bị nhiễm M. Bovis BCG ( 911 ); vắc xin phòng bệnh lao). Việc ngăn chặn các kháng thể chống lại ICAM-1 làm giảm sự xuất hiện bạch cầu trung tính ở các hạch bạch huyết khoảng 50% trong cùng một mô hình. Để giải thích khả năng phong tỏa β 2 -integrin có thể đã ngăn chặn sự thoát mạch của bạch cầu trung tính qua các tiểu tĩnh mạch nội mô cao tại các hạch bạch huyết, các nghiên cứu cũng đã được thực hiện để kiểm tra sự xâm nhập của bạch cầu trung tính ở chuột được dán nhãn CellTracker Green vào mạch bạch huyết ở da. Kết quả cho thấy rằng các kháng thể ngăn chặn chống lại β 2 -integrin hoặc ICAM-1 khiến bạch cầu trung tính tích tụ cục bộ, so với điều trị bằng kháng thể kiểm soát isotype ( 911 ).
Xét rằng bạch cầu trung tính là bạch cầu đầu tiên xâm nhập vào mô để phản ứng với tổn thương hoặc nhiễm trùng, thật hợp lý khi suy đoán rằng sự di chuyển của chúng qua nội mô bạch huyết cũng là một sự kiện rất nhanh. Khái niệm này được hỗ trợ bởi những phát hiện sử dụng bạch cầu trung tính nuôi cấy và tế bào đơn lớp tế bào nội mô bạch huyết được nuôi cấy trong các phần chèn Transwell ( 911 ). Bạch cầu trung tính dường như yêu cầu nội mô bạch huyết phải được kích hoạt bằng chất trung gian gây viêm, chẳng hạn như TNF-α, để quá trình di chuyển xảy ra. Ngoài ra, việc phong tỏa integrin β2 hoặc α4 trên bạch cầu trung tính, hoặc E-selectin, ICAM-1 hoặc VCAM-1 trên nội mô làm giảm đáng kể sự di chuyển qua các đơn lớp tế bào nội mô bạch huyết ( 911 ). Cũng cần lưu ý rằng khi kích hoạt nội mô bạch huyết, quá trình di chuyển bạch cầu trung tính diễn ra rất nhanh và có thời gian để vượt qua lớp đơn lớp khi so sánh với các tế bào đuôi gai ( 911 ).
Sự di chuyển bạch cầu trung tính cũng liên quan đến hóa hướng động đối với các chemokine ELR + CXC, đặc biệt là CXCL8, được tiết ra từ bề mặt lòng của các tế bào nội mô bạch huyết. Quá trình này dường như cũng bao gồm sự co rút nội mô do bạch cầu trung tính gây ra qua trung gian một phần là serine protease, MMP và chất chuyển hóa có nguồn gốc từ 15-lipoxygenase-1 12(S)-HETE ( 911 ). Việc tiếp xúc với các phức hợp miễn dịch cũng có thể tăng cường sự di chuyển của bạch cầu trung tính vào hệ bạch huyết ban đầu. Ở chuột được tiêm chủng kháng nguyên ovalbumin (OVA Ag), bạch cầu trung tính OVA+ xuất hiện ở cả vị trí tiêm và trong các hạch bạch huyết dẫn lưu. Bạch cầu trung tính tiếp xúc với phức hợp miễn dịch OVA/kháng OVA sẽ di chuyển hiệu quả hơn ( 647 ). Điều thú vị là các phức hợp miễn dịch có thể kích thích sự biểu hiện cao hơn của S1PR4 trong bạch cầu trung tính ở tủy xương trong ống nghiệm. Kích hoạt S1PR bằng FTY720 hoặc FTY720-P làm giảm sự xâm nhập của bạch cầu trung tính vào các hạch bạch huyết thông qua cả hai con đường ( 386 ).
Đại thực bào
Mặc dù gần đây đã có nhiều thông tin mới về vai trò của đại thực bào trong việc thúc đẩy quá trình tạo mạch bạch huyết, làm sạch kháng nguyên và giải quyết tình trạng viêm ( 526 ), nhưng có rất ít thông tin về sự vận chuyển của chúng trong bạch huyết. Một số bài báo đã mô tả sự xâm nhập của đại thực bào vào hệ bạch huyết ban đầu ( 49 , 54 ). Cơ chế xâm nhập chưa được nghiên cứu kỹ nhưng có lẽ có một số bước phổ biến như đã thấy với các tế bào miễn dịch khác.
Tế bào khối u:
Các chemokine được tạo ra bởi nội mô bạch huyết cũng có thể thu hút sự xâm nhập của các tế bào khối u vào hệ thống bạch huyết và cũng có thể thu hút các tế bào khối u đến các hạch bạch huyết ( 79 , 237 ). Cả CCR7 và CXCR4 đều được báo cáo là biểu hiện cao trong các khối u ung thư vú ác tính và mức độ biểu hiện cao của các phối tử tiếp nhận, CCL21 và CXCL12 đã được tìm thấy trong các hạch bạch huyết ( 734 ). Trục CCL1-CCR8, liên quan đến bệnh bạch cầu và ung thư hạch, và gần đây hơn là u ác tính ở người, cũng được chứng minh là có chức năng kiểm soát sự thoát ra của các tế bào khối u qua nội mô bạch huyết trong các hạch bạch huyết ( 236 ). Sự biểu hiện mạnh mẽ của protein CCL1 đã được phát hiện trong các xoang bạch huyết ở cả người và chuột, nhưng không có ở các mạch bạch huyết ngoại biên. Việc phong tỏa CCL1 hoặc CCR8 đã ngăn chặn sự xâm nhập của các tế bào khối u vào hạch bạch huyết ( 236 ). Ngoài các cơ chế về nhà này, các tế bào khối u còn gây ra sự phá vỡ thành nội mô bạch huyết. 12S-HETE có nguồn gốc từ tế bào khối u sau khi được xúc tác bởi lipoxygenase-1 (ALOX15) có thể làm suy yếu thành nội mô bạch huyết, tạo điều kiện cho tế bào khối u xâm nhập ( 532 ). Do đó, tính nhạy cảm của nội mô bạch huyết trong các hạch bạch huyết đối với sự xâm lấn phụ thuộc cả vào cơ chế dẫn về tạo điều kiện cho sự tương tác của các tế bào khối u với thành bạch huyết và cả mức độ hoạt động ác tính/ác tính của các tế bào khối u.
Các bài viết liên quan
Thomas Bartholin và hệ bạch huyết
Hiệu quả của việc dẫn lưu bạch huyết bằng tay trong điều trị tích cực giai đoạn I của bệnh phù bạch huyết liên quan đến ung thư vú
Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
Danh mục sản phẩm
-
Hotline mua hàng 096.7786.399
-
Giao hàng miễn phí Đơn hàng >1tr
-
Sản phẩm chính hãng Cam kết chính hãng 100%