Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 6: Cơ chế viêm và xử lý viêm
- Xuất bản: trực tuyến năm 2018 ngày 13 tháng 12
- Tác giả: Jerome W. Breslin , 1 Ying Yang , 1 Joshua P. Scallan , 1 Richard S. Sweat , 2 Shaquria P. Adderley , 1 và W. Lee Murfee 3
- Link nghiên cứu: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6459625/
Xem lại PHẦN 5 của nghiên cứu này.
Ảnh hưởng của tế bào viêm và chất trung gian hòa tan
Nội dung chính [hiện]
Lưu lượng bạch huyết tăng lên thường đi kèm với tình trạng viêm. Việc áp dụng các peptide như fMLP làm tăng sự thoát mạch của bạch cầu cũng tạo ra sự gia tăng hoạt động bơm bạch huyết và lưu lượng bạch huyết lớn hơn {Benoit, 1992 #844}. Tuy nhiên, tác động trực tiếp của tế bào miễn dịch lên quá trình bơm bạch huyết vẫn chưa rõ ràng. Các tế bào tủy biểu hiện iNOS và là CD11b + và GR-1 + , có thể đại diện cho bạch cầu đơn nhân, bạch cầu trung tính và bạch cầu ái toan, đã được báo cáo là làm suy giảm khả năng bơm của bạch huyết vùng khoeo chuột trong cơ thể do giải phóng NO qua trung gian iNOS ( 601 ). Ở chuột được điều trị bằng LPS, bạch cầu trung tính giảm liên kết với bạch huyết thu thập ở mạc treo và tăng tích lũy đại thực bào CD163 + CD206 + (kiểu hình M2) đi kèm với suy giảm co thắt bạch huyết, tuy nhiên mối quan hệ nhân quả không rõ ràng ( 178 ). Trong mô hình chuột mắc hội chứng chuyển hóa, các đại thực bào có kiểu hình M1 (CD163 + MHCII + ) tích tụ gần các mạch bạch huyết mạc treo ruột và có liên quan đến tình trạng bơm bị suy yếu có thể được phục hồi một phần bằng cách phong tỏa các kênh NOS hoặc K ATP ( 1203 ). Tuy nhiên, tác động trực tiếp của các tế bào này lên hoạt động co bóp của bạch huyết vẫn chưa được xác định.
- Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
- Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
- Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
- Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
- Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Nhiều công việc đã được thực hiện để kiểm tra vai trò của tế bào mast, được tìm thấy với mật độ tương đối cao gần các mạch bạch huyết trong mạc treo chuột ( 182 ). Tế bào mast niêm mạc ruột cũng ảnh hưởng đến hệ bạch huyết ở ruột và mạc treo khi chúng được kích hoạt bởi một số chất dinh dưỡng ( 484 , 953 ). Ở chuột lang được kích thích bằng sữa bò và sau đó được điều trị bằng beta-lactoglobulin để kích hoạt sự thoái hóa tế bào mast, tần số co thắt mạch bạch huyết mạc treo tăng lên, trong khi biên độ co bóp giảm. Phản ứng này có thể được giảm bớt bằng chất đối kháng thụ thể histamine H1, cho thấy rằng histamine là chất trung gian chính của phản ứng ( 864 ). Trong một loạt nghiên cứu gần đây hơn, vai trò của tế bào mast trong việc điều chỉnh quá trình bơm bạch huyết được thể hiện rõ ràng theo quá trình lão hóa. Những nghiên cứu này sử dụng chuột Fischer-344, một mô hình lão hóa đã được thiết lập, trong đó chuột 9 tháng tuổi đại diện cho tuổi trưởng thành và chuột 24 tháng tuổi đại diện cho người già. Sự co bóp của bạch huyết và dòng bạch huyết bị suy giảm đáng kể ở chuột già do tình trạng viêm gia tăng ( 18 , 362 , 365 , 367 , 743 , 1067 ). Điều này bao gồm mức độ kích hoạt tế bào mast cao hơn ở chuột già ( 182 ). Sự gia tăng kích hoạt tế bào mast ở chuột già đi kèm với việc giảm khả năng phản ứng của các mạch bạch huyết thu thập ở mạc treo để tăng cường tần số và trương lực co bóp để đáp ứng với LPS ( 769 ). Mức độ kích hoạt tế bào mast tăng cao ở chuột già cũng tương quan với việc tăng kích hoạt cơ bản của NF-κB. Mức độ kích hoạt cơ bản cao này về cơ bản tạo ra bất kỳ sự khác biệt nào do sự kích thích bổ sung do LPS gây ra đối với NF-κB là không đáng kể, điều này có thể làm giảm khả năng phản ứng của các mạch bạch huyết với các kích thích viêm cấp tính ( 769 ). Ngoài ra, sự thoái hóa tế bào mast dường như thu hút bạch cầu ái toan và tế bào dương tính MHC loại II đến hệ bạch huyết thu thập ở mạc treo, tuy nhiên chức năng này bị suy giảm ở chuột già ( 183 ). Dựa trên dữ liệu hiện tại, có vẻ như tế bào mast tác động đến chức năng bạch huyết thông qua việc giải phóng histamine và có thể cả các chất trung gian khác.
Có một số điều phức tạp liên quan đến cách histamine tác động đến việc bơm bạch huyết. In vivo , histamine làm tăng cả khả năng lọc và tính thấm của vi mạch ( 179 , 295 ), làm tăng sự hình thành bạch huyết ( 1109 ). Kết quả có thể thấy được khi bôi histamine tại chỗ vào mạc treo bên ngoài của chuột, với sự gia tăng rõ rệt của dòng bạch huyết trong việc thu thập bạch huyết có đường kính tăng lên và các cơn co thắt từng pha mạnh hơn mà không thay đổi tần số ( 325 ). Tăng áp lực tưới máu bạch huyết ở chi trước của chó để đáp ứng với histamine cũng đã được báo cáo ( 271 ). Trong ống nghiệm , đã có những phản ứng khác nhau với histamine với các chế phẩm thử nghiệm khác nhau. Sự co bóp nhịp nhàng của các dải bạch huyết bò bị cô lập đã được báo cáo ( 497 , 785 ). Các phản ứng phụ thuộc vào nồng độ cũng được báo cáo ở hệ bạch huyết mạc treo bò, với nồng độ cao (>5 μM) làm tăng tần số co bóp và nồng độ thấp hơn (50 nM – 1 μM) làm giảm tần số co bóp ( 1125 ), có thể là do các histamine khác nhau các phân nhóm thụ thể ( 347 , 1125 ). Trong các vòng mạch bạch huyết khí phế quản, người ta đã báo cáo rằng histamine gây ra sự co thắt có thể được nới lỏng theo cách phụ thuộc vào nội mô bởi bradykinin hoặc acetylcholine ( 326 ). Mặt khác, ở ống ngực của chó, mặc dù histamine có thể tự gây ra sự co thắt nhưng nó cũng có thể gây giãn mạch sau khi norepinephrine gây co thắt mạch máu ( 1046 ). Ở hệ bạch huyết của lợn, histamine cũng có thể gây co thắt nhưng cũng có thể gây giải phóng NO nội mô ( 898 ). Trong bạch huyết mạc treo được phân lập từ chuột, histamine được sử dụng ở nồng độ thấp (1 – 10 nM) đã được báo cáo là làm tăng tần số và biên độ co bóp, trong khi ứng dụng ở nồng độ cao hơn (1 – 100 μM) làm giảm tần số và biên độ co bóp phụ thuộc vào nội mô ( 860 ) . Sự thư giãn các mạch bạch huyết mạc treo chuột bị cô lập bởi histamine có thể bị ức chế bằng cách phong tỏa dược lý quá trình tổng hợp NO bằng L-NAME hoặc hoạt động guanylate cyclase hòa tan ( 567 ). Ngoài ra, khi sử dụng histamine ở nồng độ tương đối cao (100 mM), cả hai chất đối kháng thụ thể histamine H1 và H2 đều có khả năng ngăn chặn sự thư giãn bạch huyết do histamine gây ra ( 567). Một phát triển thú vị khác là bằng chứng về việc sản xuất histamine bởi các tế bào nội mô của mạch bạch huyết mạc treo chuột từ chuột già (24 tháng tuổi) và khả năng histamine thay thế NO như một yếu tố thư giãn có nguồn gốc từ nội mô ( 770 , 771 ).
Các chất trung gian gây viêm khác như bradykinin cũng làm tăng sự thoát mạch của chất lỏng giàu protein và có thể dự kiến sẽ tăng lưu lượng bạch huyết, bằng chứng là sự gia tăng áp lực tưới máu bạch huyết ở chi trước của chó sau khi truyền bradykinin ( 272 ). Ở mạc treo chuột, bradykinin làm tăng tần số co bóp của bạch huyết mà không làm thay đổi đường kính cuối tâm thu hoặc tâm trương ( 1182 ), điều này có thể phản ánh cả tác động trực tiếp lên mạch bạch huyết và sự hình thành bạch huyết tăng cao thứ phát do rò rỉ huyết tương ở vi mạch. Tác động trực tiếp của bradykinin lên mạch bạch huyết bao gồm cả tăng cường co thắt ( 46 , 271 , 1060 ) và tác dụng làm giãn cơ thông qua kích hoạt nội mô và giải phóng NO ( 105 , 323 , 1060 ).
Công việc bổ sung cũng có thể được tìm thấy liên quan đến cách các chất trung gian gây viêm ảnh hưởng đến việc bơm bạch huyết. Căng thẳng oxy hóa dường như có tác dụng ức chế quá trình bơm bạch huyết ( 1199 ). Các chất chuyển hóa axit arachidonic dường như có tác động khác biệt đến sự co thắt bạch huyết. Leukotrienes B4, C4 và D4 đã được báo cáo là có tác dụng kích thích các cơn co thắt ( 497 ). Prostaglandin PGH 2 hoặc chất tương tự U46619 của nó, là một chất kích thích co thắt bạch huyết tương tự như Thromboxane A2 ( 496 , 497 , 989 , 992 , 994 ) trong khi Prostaglandin PGE 1 và PGE 2 có thể ức chế các cơn co thắt được kích thích bởi U46619 ( 497 ). Các chất ức chế cyclooxygenase như aspirin và indomethacin, hoặc chất ức chế cyclooxygenase/lipoxygenase kết hợp BW-755C có thể làm giảm sự co thắt tự phát của hệ bạch huyết ( 495 , 496 ). Isoprostane 8-epi-PGF2α cũng có khả năng kích thích sự co bóp của bạch huyết ( 990 ). Cuối cùng, những tín hiệu riêng lẻ này bao gồm một cơ chế tích hợp lớn hơn góp phần vào chu trình co bóp tổng thể của bạch huyết.
Kiểm soát các van thứ cấp trong việc thu thập bạch huyết
Các van thứ cấp rất cần thiết để bạch huyết chảy về phía trước trong toàn mạng lưới, bằng chứng là một số đột biến gen nhất định, chẳng hạn như ở gen Foxc2 , gây mất van và phù bạch huyết ( 132 , 557 , 685 , 859 ). Các lá van hoạt động như các cổng thụ động mở hoặc đóng để đáp ứng với độ dốc áp suất thủy tĩnh xuyên van của bạch huyết. Ngoài ra, đặc tính cấu trúc của các lá van, số Reynolds thấp và dòng chảy có độ nhớt cao chi phối vị trí cổng ( 964 ). Cấu trúc van về cơ bản là một lớp nội mô gấp nếp, với các mặt đáy của các tế bào nội mô hướng vào nhau. Ở giữa hai tấm tế bào nội mô, collagen tạo thành một lớp liên kết giúp tăng thêm độ cứng. Ngoài ra, mạng lưới sợi collagen còn hỗ trợ phần đế của mỗi lá van ( 665 , 881 ).
Sinh lý học của việc đóng cổng van gần đây đã được khám phá với các hạch bạch huyết được đóng ống, cô lập. Để nghiên cứu trực tiếp việc giao phối trong môi trường trong đó áp suất thủy tĩnh ngược dòng và hạ lưu được kiểm soát chặt chẽ, các đoạn mạch bạch huyết có một van duy nhất được đóng ống bằng pipet dòng vào và dòng ra để có thể áp đặt áp suất. Mạch cũng có thể được thư giãn bằng dung dịch tắm không chứa Ca 2+ để ngăn ngừa ảnh hưởng của các cơn co thắt. Một pipet servo null bổ sung xuyên qua thành bình và được đặt gần phía thượng nguồn của van cho phép thay đổi áp suất cục bộ, chính xác ảnh hưởng đến cổng van. Cấu hình thứ hai cho phép nghiên cứu cách các van ngược dòng và xuôi dòng của hạch bạch huyết mở và đóng trong chu kỳ co bóp sử dụng đoạn mạch hai van được gắn trên pipet dòng vào và dòng ra, với pipet thứ ba xuyên qua thành giữa hai van để đo áp suất trong lòng van ( 248 , 945 ).
Từ các nghiên cứu sử dụng các mô hình này, rõ ràng là các lá van có xu hướng thiên về vị trí mở khi không có gradient áp suất xuyên van. Ý nghĩa chức năng có thể là giảm sức cản dòng chảy trong các điều kiện trong đó có gradient áp suất rất nhỏ, mặc dù điều này cũng có thể cho phép một mức độ dòng chảy ngược nhất định tại một số điểm nhất định dọc theo chu kỳ co lại ( 248 ). Điều này cũng được thấy rõ ở đoạn hai van trong phần lớn tâm trương. Tuy nhiên, khi áp suất dòng ra vượt quá áp suất dòng vào, mô hình cổng giống như được thấy ở van tâm thất của tim ( 248 ). Ngoài ra, khả năng đóng van còn phụ thuộc một phần vào đường kính bình. Khi đường kính tương đối nhỏ, chẳng hạn như trong thời kỳ tâm thu, chênh lệch áp suất bất lợi 0,1 – 0,3 cm H 2 O là đủ để đóng van. Tuy nhiên, khi đường kính của bình đạt đến mức tối đa thì cần phải có gradient áp suất xuyên van cao hơn nhiều (vài cm H 2 O) để đóng van. Ý nghĩa chức năng là trương lực có thể tác động đến cổng van và các mạch bạch huyết vẫn bị giãn, chẳng hạn như trong phù bạch huyết, có thể có xu hướng trục trặc ở van thứ cấp ( 93 – 95 , 248 , 957 ). Cơ chế “khóa van”, trong đó van khóa mở khi lớp cơ trơn bạch huyết ở áp suất dòng chảy ra cao trở nên mệt mỏi và không thể đẩy bạch huyết về phía trước nữa, đã được mô tả và về cơ bản sẽ cho phép áp suất dòng chảy ra được truyền ngược lại qua mạch bạch huyết đến van dòng vào của nó ( 960 ). Nếu loại hiện tượng này lặp lại và lan truyền qua một số hạch bạch huyết, chức năng bình thường để ngăn chặn sự chênh lệch áp suất lớn sẽ bị mất, gây ra sự suy giảm tổng thể của mạch máu trong việc đẩy bạch huyết về phía trước ( 960 ).
Tính thấm của việc thu thập bạch huyết
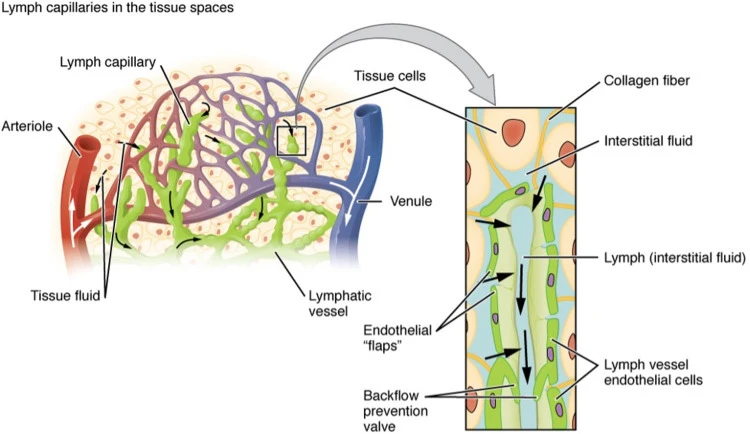
Mạch bạch huyết trong cân bằng chất lỏng và đại phân tử
Trong lịch sử, việc thu thập các mạch bạch huyết được coi là không thấm đối với các chất đã xâm nhập vào lòng mạch bạch huyết, bao gồm chất lỏng và protein ( 664 ). Tuy nhiên, quan điểm này đã bị bác bỏ trong thập kỷ qua bởi dữ liệu từ các nghiên cứu đã thành công trong việc định lượng trực tiếp tính thấm của từng mạch bạch huyết đối với các đại phân tử ( 957 – 959 ) và cho thấy mức độ khác nhau của dòng chất tan qua thành bạch huyết liên quan đến kích thước phân tử. ( 818 ). Sự hiểu biết đã được sửa đổi này về tính thấm của nội mô bạch huyết đã dẫn đến các chức năng vận chuyển bạch huyết mới được đề xuất ngoài việc chỉ duy trì sự cân bằng chất lỏng.
Trong nghiên cứu đầu tiên xác định trực tiếp hệ số thấm của mạch bạch huyết, người ta quan sát thấy rằng cả mao mạch bạch huyết và mạch bạch huyết góp đều có khả năng thấm qua albumin được đánh dấu huỳnh quang được tưới máu trong lòng ( 959 ). Bởi vì hệ số thấm được tính toán phụ thuộc vào các phép đo trực tiếp dòng chất tan, diện tích bề mặt mạch và nồng độ trong và trong bụng của chất đánh dấu ở áp suất thủy tĩnh không đổi, nên để làm rõ hướng chuyển động của albumin in vivo qua thành bạch huyết thu thập cũng cần phải đo nồng độ nồng độ albumin của bạch huyết, huyết tương và dịch kẽ trong cơ thể . Việc đo các thông số này cho thấy độ dốc bình thường của sự di chuyển albumin qua các mạch bạch huyết thu thập là từ lòng đến kẽ ( 959 ). Nói cách khác, bằng chứng hiện tại cho thấy rằng các protein thường “rò rỉ” ra khỏi mạch bạch huyết thu thập do chênh lệch nồng độ và áp suất thủy tĩnh cao hơn của các mạch này so với mao mạch bạch huyết. Nghiên cứu tương tự cũng cho thấy tính thấm của mạch bạch huyết thu thập không khác biệt với tính thấm của tiểu tĩnh mạch, là vị trí chính gây rò rỉ protein huyết tương ở vi mạch. Mặc dù thoạt nhìn điều này có vẻ cho thấy lượng albumin rò rỉ từ việc thu thập bạch huyết và tĩnh mạch là như nhau, nhưng thực tế nó lại khá khác nhau. Các mạch bạch huyết góp có đường kính lớn hơn nhiều so với tĩnh mạch, do đó diện tích bề mặt cao hơn và chúng hoạt động ở áp suất thủy tĩnh thấp hơn, làm giảm sự vận chuyển chất tan được mang theo chất lỏng (tức là lực cản đối lưu). Vì vậy, lượng chất tan di chuyển qua thành mạch bạch huyết (tức là dòng chất tan) phải cao hơn lượng chất tan trong tĩnh mạch để duy trì tính thấm như nhau. Thật vậy, khi đo dòng albumin trong mạch bạch huyết ở áp suất cao hơn quan sát được ở tĩnh mạch thì nó cao hơn nhiều ( 958 ). Ý tưởng cho rằng mạch bạch huyết thu thập có tính thấm và chất tan bị mất từ lòng mạch bạch huyết đến các mô dường như mâu thuẫn với vai trò nổi tiếng của nó trong việc đảm bảo cân bằng chất lỏng. Tuy nhiên, chỉ một tỷ lệ nhỏ chất trong lòng được lọc vào kẽ, trong khi phần lớn được vận chuyển xuôi dòng đến các hạch bạch huyết, ống ngực và cuối cùng vào máu.
Các nghiên cứu ban đầu được thực hiện bởi Drinker và đồng nghiệp ( 284 ) đã chứng minh rằng một chức năng khác của mạch bạch huyết là vận chuyển các protein lớn từ mô vào máu, vì dòng máu thường không tái hấp thu các đại phân tử bị rò rỉ. Từ lâu, người ta cũng đánh giá cao rằng mạch bạch huyết có vai trò quan trọng trong việc vận chuyển lipid ngoại vi và chế độ ăn uống vào máu ( 605 , 776 ). Nếu chúng ta cho rằng việc thu thập các mạch bạch huyết không chỉ thấm vào protein mà còn thấm vào lipid, thì điều này giúp giải thích tại sao mô mỡ luôn nằm xung quanh các mạch bạch huyết và các hạch bạch huyết ( 417 ). Một hệ quả thú vị của cả việc vận chuyển và rò rỉ lipid vào mô là mạch bạch huyết có thể đóng vai trò gây ra bệnh béo phì khi tính thấm tăng cao. Dữ liệu từ một nghiên cứu duy nhất cho đến nay cung cấp sự hỗ trợ cho khả năng này, nhưng vẫn còn gây tranh cãi vì nó chưa được các nhóm khác nhân rộng ( 418 ). Cuối cùng, các mạch bạch huyết đã được chứng minh là có khả năng vận chuyển kháng nguyên có nguồn gốc từ các mô và tính thấm của chúng cho phép các tế bào miễn dịch thực bào gần đó thu được kháng nguyên ( 560 ).
Phương pháp xác định tính thấm nội mô bạch huyết
Một số phương pháp tồn tại để đo tính thấm của mạch bạch huyết, bao gồm các phương pháp in vivo, in vitro và ex vivo . Ở đây, những ưu điểm và hạn chế của từng loại sẽ được thảo luận. Sự dễ dàng tương đối mà các tế bào nội mô bạch huyết (LEC) từ nhiều nguồn khác nhau có thể được duy trì trong ống nghiệm đã khiến nuôi cấy tế bào trở thành một phương pháp phổ biến để nghiên cứu tính thấm của bạch huyết. Tính thấm của các tế bào hợp lưu có thể được xác định bằng cách đo tốc độ mà một phân tử huỳnh quang có thể đi qua một lớp tế bào đơn phát triển trên một lớp chèn màng Transwell, trong đó phân tử huỳnh quang được thêm vào ngăn chất lỏng “lòng” hoặc phía đỉnh và tốc độ của Sự xuất hiện của nó trong chất lỏng ở mặt “bụng” hoặc mặt đáy được đo theo thời gian. Với tốc độ này, hoặc dòng chất tan, cùng với diện tích bề mặt để khuếch tán, và nồng độ khoang trong và bụng, hệ số thấm có thể được tính từ Định luật khuếch tán thứ nhất của Fick ( 295 ). Một phương pháp khác là đánh giá chức năng rào cản của các lớp đơn tế bào bằng cách đo điện trở trên toàn lớp, điều này có thể thể hiện tốt hơn tính thấm đối với các ion nhỏ. Có rất nhiều lợi ích khi nghiên cứu một lớp LEC. Đầu tiên, với những tiến bộ gần đây trong phương pháp nuôi cấy tế bào để phân lập và phát triển thành công LEC, các mô hình đơn lớp có thể dễ dàng học được và các thí nghiệm có thể được thực hiện nhanh chóng. Ngoài ra, phương pháp này mang lại những lợi ích đi kèm với việc chuyển đổi tế bào, chẳng hạn như phân hủy gen hoặc chuyển gen (ví dụ: protein tổng hợp phóng viên) khi các thí nghiệm được thực hiện với các tế bào có nguồn gốc từ con người hoặc chưa có sẵn chuột biến đổi gen. Ngoài ra, động lực học dưới tế bào thường khó nhìn thấy trong môi trường in vivo phức tạp có thể được hiển thị trực tiếp trong thời gian thực (chụp ảnh tế bào sống) hoặc sau khi cố định và dán nhãn miễn dịch. Cuối cùng, khi cần giải thích về các cơ chế nội bào cụ thể trong LEC, các nghiên cứu đơn lớp LEC mang đến sự đơn giản trong việc giải thích dữ liệu. Tuy nhiên, những ưu điểm này phải được cân nhắc trước nhiều hạn chế của mô hình đơn lớp LEC. Độc canh LEC thiếu các loại tế bào khác góp phần tạo ra tính thấm cơ bản thấp, bao gồm tế bào cơ trơn và tế bào miễn dịch. Các đặc tính nền của màng nền cũng có thể khác nhau đáng kể. Bởi vì các tế bào trong môi trường nuôi cấy không ở trong ống tròn 3 chiều nên chúng có thể chịu áp lực và lực cắt khác với ống tròn. Ngoài ra, các lớp đơn LEC không thể phát triển các cấu trúc van phức tạp. Các tín hiệu vi môi trường mô cục bộ từ bạch huyết, hormone tuần hoàn hoặc dây thần kinh cũng không có. Hơn nữa, LEC nuôi cấy có xu hướng có độ thẩm thấu cơ bản với albumin cao hơn ít nhất 10 lần so với báo cáo sử dụng in vivo hoặc ex vivophương pháp; do đó khả năng đo lường phản ứng của chúng với các kích thích khác nhau có thể sẽ bị giảm đi hoặc có thể có các khoảng thời gian rất khác so với phản ứng trong cơ thể ( 220 , 870 , 919 ). Điều này rất có thể giống với kiểu hình gây viêm được các tế bào nội mô máu chấp nhận trong nuôi cấy ( 220 ). Người ta cũng chưa biết LEC trong môi trường nuôi cấy phản ánh bản sắc mao mạch bạch huyết hoặc mạch thu thập ở mức độ nào.
Một cách tiếp cận phổ biến khác để đánh giá tính toàn vẹn của mạch bạch huyết là tiêm dưới da một loại thuốc nhuộm mờ đục vào tai chuột, nơi các mạch bạch huyết nhanh chóng hấp thụ nó và có màu xanh lam. Thông thường nhất, dung dịch thuốc nhuộm Evans Blue 1% được sử dụng. Sau một thời gian, hình ảnh của các mạch bạch huyết sẽ thu được để cho thấy mức độ thuốc nhuộm màu xanh đã rò rỉ từ lòng vào các mô xung quanh của tai. Ưu điểm của phương pháp này là cho phép điều tra sự rò rỉ mạch bạch huyết trong cơ thể trong điều kiện sinh lý, tương đối dễ thực hiện và có thể được sử dụng kết hợp với chuột bị loại. Tuy nhiên, người ta phải cẩn thận để tránh cho rằng sự rò rỉ chất tan có liên quan trực tiếp đến tính thấm của chất tan. Tốt nhất, sự rò rỉ chất tan tương quan với dòng chất tan, tức là lượng chất tan vượt qua hàng rào nội mô theo thời gian, bị ảnh hưởng bởi cả tính thấm của mạch và mức độ lọc do chênh lệch áp suất thủy tĩnh và thẩm thấu. Phương pháp tiêm thuốc nhuộm Evans Blue cũng bị hạn chế ở chỗ nó đòi hỏi sự hấp thu albumin được đánh dấu bằng thuốc nhuộm từ khoảng kẽ, do đó tốc độ có thể thay đổi, tùy thuộc vào áp suất chất lỏng kẽ. Nồng độ thuốc nhuộm cao có thể sẽ khiến phần lớn thuốc nhuộm không liên kết với albumin; do đó sự rò rỉ phản ánh tốt hơn trọng lượng phân tử nhỏ hơn của thuốc nhuộm. Lượng thuốc nhuộm được tiêm vào tai từ ống tiêm thường không được kiểm soát tốt nên áp suất kẽ và quan trọng hơn là áp lực mạch bạch huyết không được xác định và không được kiểm soát, cả hai đều ảnh hưởng lớn đến dòng chất tan. Do những hạn chế này, việc so sánh hai nhóm chuột bị loại khác nhau để xác định xem nhóm nào có mức độ rò rỉ cao hơn sẽ trở nên khó khăn. Một khi thuốc nhuộm đã được tiêm vào tai chuột, nó sẽ không thể được tiêm lại sau khi điều trị, vì vậy kỹ thuật này không thể lặp lại.
Cho đến nay, một nghiên cứu duy nhất đã trực tiếp xác định tính thấm của các mao mạch bạch huyết riêng lẻ và thu thập bạch huyết trong cơ thể ( 959 ). Cách tiếp cận này bao gồm việc bơm các mạch bạch huyết đơn lẻ vào mạc treo chuột bằng một micropipette thủy tinh nhỏ và tưới vào mạch một chất tan huỳnh quang. Mặc dù ưu điểm là phương pháp này mang tính định lượng, cung cấp các biện pháp trực tiếp về loại tàu đã biết và cho phép thẩm vấn dược lý, nhưng công suất tương đối thấp, thách thức về mặt kỹ thuật và tốn nhiều công sức. Chỉ những mạch không được bao phủ hoàn toàn bởi mô mỡ mới có thể dễ dàng được đặt ống thông, và các mạch thu thập mạc treo chuột chuột co lại một cách tự nhiên, do đó thể tích và huỳnh quang của chúng liên tục thay đổi. Cuối cùng, áp suất thủy tĩnh của dịch truyền phải cao hơn áp suất trong bình nên không thể kiểm soát hoàn toàn biến số này.
Để giải quyết các vấn đề với phương pháp sau, cùng nhóm này đã phát triển một xét nghiệm ex vivo mới tương tự như các xét nghiệm được sử dụng trong các nghiên cứu in vivo ( 958 ). Với xét nghiệm ex vivo , các mạch bạch huyết thu thập được phẫu thuật cắt bỏ khỏi mạc treo chuột và sau đó được truyền vào hai micropipette thủy tinh (Hình 34). Một lợi thế của việc sử dụng các mạch bạch huyết thu thập mạc treo chuột là các mạch này không có sự co bóp mạnh mẽ, tự phát nên đường kính, do đó thể tích, của mạch không đổi dẫn đến kết quả đo nhanh (< 5 phút). Ưu điểm nữa là phương pháp này cho phép kiểm soát hoàn toàn áp suất thủy tĩnh, áp suất thẩm thấu, gradient dòng chảy, hàm lượng dung dịch ở vùng bụng và vùng bụng. Điều này lại tạo điều kiện thuận lợi cho việc bổ sung các chất chủ vận/đối kháng dược lý, kháng thể ngăn chặn chức năng hoặc các hóa chất khác để nghiên cứu cơ chế. Bởi vì phương pháp này được sử dụng với chuột, nên nó cũng cho phép sử dụng số lượng lớn chuột bị loại hoặc biến đổi gen có sẵn để nghiên cứu vai trò cụ thể của các gen được chọn trong việc kiểm soát tính thấm. Hạn chế của mô hình này là nó đòi hỏi phải nghiên cứu các mạch máu bên ngoài môi trường vi mô bình thường của chúng, chuyên môn kỹ thuật trong việc mổ xẻ và đặt ống thông mạch cẩn thận và chỉ có thể nghiên cứu thu thập các mạch bạch huyết vì mao mạch bạch huyết quá mỏng và dễ vỡ với các phương pháp điều trị hiện tại.

Xác định độ thấm chất tan của các mạch bạch huyết góp riêng biệt, đóng hộp. MỘT . Các mạch bạch huyết mạc treo chuột được phân lập và đưa vào micropipette thủy tinh. Pipet dòng vào (trái) là pipet “theta” có vách ngăn cho phép truyền dung dịch từ hai bình chứa khác nhau, được biểu thị bằng màu xanh lam và xanh lục (i). Dòng chảy được kiểm soát bằng cách tăng áp suất dòng vào trong bể chứa màu xanh lam (không có chất đánh dấu) hoặc màu xanh lá cây (không có chất đánh dấu huỳnh quang). Khi chất đánh dấu được truyền vào, ban đầu nó chỉ được quan sát thấy trong lòng mạch (ii), nhưng sau một khoảng thời gian ngắn, một số chất đánh dấu sẽ rò rỉ qua thành mạch vào bể xung quanh (iii). Bảng B hiển thị hình ảnh trường sáng của ống bạch huyết (trên cùng), hình ảnh huỳnh quang trong quá trình truyền dịch bằng dung dịch muối sinh lý không có chất đánh dấu (giữa) và trong quá trình truyền dịch bằng dung dịch chứa albumin huỳnh quang (phía dưới). Nền đỏ trong ảnh huỳnh quang là do bộ lọc hồng ngoại cho phép đo đường kính trong suốt quá trình ghi. C . Dấu vết cường độ huỳnh quang của bình và khu vực xung quanh được ghi lại bằng quang kế. Ban đầu, cường độ huỳnh quang cơ bản được ghi lại, tương ứng với hình ảnh (i) trong bảng A. Khi truyền albumin huỳnh quang, tương ứng với hình ảnh (ii) trong bảng A , cường độ sẽ tăng dần theo từng bước, sau đó là tăng dần (iii) do dòng chất đánh dấu xuyên qua thành mạch. Sau khi rửa trôi, cường độ huỳnh quang trở về mức cơ bản. Độ tăng ban đầu (ii trong Bảng C ) và độ dốc (iii trong bảng C ) biểu thị sự chênh lệch nồng độ ban đầu trên thành bình và dòng chất tan của chất đánh dấu, cùng với diện tích của thành bình có thể được sử dụng để giải quyết hệ số thấm chất tan sử dụng Định luật khuếch tán thứ nhất của Fick. Sao chép từ tài liệu tham khảo ( 958 ) với sự cho phép.
Tính thấm của mạch bạch huyết trong bệnh tật
Gần đây, người ta đã nhận ra rằng có mối liên hệ giữa sự phát triển của van bạch huyết và sự điều hòa tính thấm của bạch huyết ( 945 ). Vì vậy, sẽ rất thú vị khi kiểm tra xem liệu rối loạn chức năng van và/hoặc tính thấm bạch huyết tăng nghiêm trọng có phải là nguyên nhân gây ra phù bạch huyết nguyên phát hay không. Các cơ chế sinh lý bổ sung đã được xác định trong sự phát triển của phù bạch huyết thứ phát và bao gồm các cơn co thắt cơ trơn bạch huyết bị khiếm khuyết ( 1019 ) hoặc viêm qua trung gian tế bào T trong mô thứ phát do ứ đọng bạch huyết ( 45 ). Người ta biết nhiều hơn đáng kể về sinh lý bệnh của phù bạch huyết thứ phát do sự phát triển của một số mô hình chuột bị phù bạch huyết thứ phát, trong khi hiện tại không có mô hình chuột nào bị phù bạch huyết nguyên phát tái phát tình trạng sưng tấy nghiêm trọng quan sát thấy ở bệnh nhân người.
Ngoài tầm quan trọng rõ ràng của mạng lưới bạch huyết trong việc ngăn ngừa phù nề, những tiến bộ gần đây đã phát hiện ra vai trò mới của mạch bạch huyết trong một số bệnh tim mạch chính, bao gồm béo phì, tăng cholesterol máu, xơ vữa động mạch và tiểu đường loại 2 ( 418 , 604 , 605 , 652 , 958 ) . Điều thú vị là trong tất cả các bệnh chuyển hóa này, các mạch bạch huyết đều bị rò rỉ quá mức.
Ở chuột đơn bội đủ Prox1 , một yếu tố phiên mã điều chỉnh số phận tế bào ở các cơ quan khác nhau, các mạch bạch huyết đã được chứng minh là rò rỉ bạch huyết giàu lipid vào các mô, cho thấy tính thấm của bạch huyết tăng lên ( 418 ). Sau đó, bạch huyết đã được chứng minh là có tác dụng kích thích quá trình tạo mỡ trong ống nghiệm như một lời giải thích cho tình trạng béo phì khởi phát ở người trưởng thành. Do Prox1 được biểu hiện ở nhiều cơ quan hoạt động trao đổi chất nên dẫn đến câu hỏi liệu tình trạng béo phì ở mô hình chuột này có đặc hiệu với bạch huyết hay không. Ngoài ra, đây là mô hình chuột duy nhất có khiếm khuyết bạch huyết dẫn đến béo phì. Tuy nhiên, gần đây người ta đã chứng minh rằng sự biểu hiện quá mức của Prox1 trong nội mô bạch huyết trên nền dị hợp tử toàn cầu Prox1 đã cứu được kiểu hình béo phì ( 314 ). Những người khác cho rằng béo phì dẫn đến viêm mãn tính, sau đó có thể dẫn đến rối loạn chức năng hàng rào bạch huyết ( 431 ). Kết hợp lại, hai khái niệm này gợi ý rằng có tiềm năng tạo ra một vòng phản hồi tích cực giữa tính thấm của bạch huyết và tình trạng béo phì, điều này có thể dẫn đến sự lắng đọng và viêm mỡ cấu thành.
Một trạng thái trao đổi chất khác dẫn đến rò rỉ mạch bạch huyết là tăng cholesterol máu ( 604 , 605 ). Những con chuột thiếu ApoE được áp dụng chế độ ăn kiêng xơ vữa sẽ bị tăng cholesterol máu. Khi tiêm một loại thuốc nhuộm mờ đục vào tai, các mạch bạch huyết nhanh chóng hấp thụ, sau đó rò rỉ thuốc nhuộm này vào nhu mô xung quanh, cho thấy rò rỉ nghiêm trọng ( 604 ). Trong một nghiên cứu sau đó, cùng một nhóm đã chứng minh rằng sự rò rỉ bạch huyết có thể được giải quyết bằng cách bình thường hóa mức cholesterol trong huyết tương, chứng minh rằng ApoE cần thiết cho chức năng bạch huyết bình thường ( 605 ). Điều thú vị là, các mạch bạch huyết từ chuột tăng cholesterol máu đã điều hòa giảm biểu hiện Foxc2 và có mức độ bao phủ tế bào tranh tường quá mức. Mất Foxc2 cũng dẫn đến VE-cadherin bị gián đoạn tại các điểm nối tế bào-tế bào ( 945 ), vì vậy điều này có thể giải thích tại sao các mạch bạch huyết bị rò rỉ trong mô hình này.
Bởi vì béo phì có thể dẫn đến rò rỉ mạch bạch huyết do viêm mãn tính và người béo phì cũng phát triển bệnh tiểu đường loại 2, một nghiên cứu khác đã kiểm tra xem liệu các mạch bạch huyết có bị rối loạn chức năng hay không trên mô hình chuột mắc bệnh tiểu đường loại 2 ( 958 ). Ở chuột db/db bị béo phì và tăng đường huyết trong 20–30 tuần, tính thấm của mạch bạch huyết thu thập đã tăng lên đáng kể trong các thử nghiệm ex vivo và in vivo . Các chất chủ vận dược lý làm tăng sản xuất oxit nitric đã giúp cải thiện đáng kể tính thấm, xác định rối loạn chức năng nội mô bạch huyết là một thành phần mới của bệnh tiểu đường loại 2.
Điều hòa tính thấm của mạch bạch huyết bởi các tế bào miễn dịch và các chất trung gian gây viêm
Mạch bạch huyết rất quan trọng trong việc vận chuyển các tế bào miễn dịch đến các hạch bạch huyết tại chỗ để bắt đầu các phản ứng miễn dịch ( 885 ). Giống như các mạch máu bị ảnh hưởng bởi sự vận chuyển và di chuyển tế bào miễn dịch, chức năng của mạch bạch huyết cũng được điều hòa bởi các tế bào miễn dịch gần đó. Một tập hợp con các tế bào biểu hiện dấu hiệu tế bào đuôi gai (DC) Cd11c và MHCII được phát hiện tụ tập xung quanh việc thu thập các mạch bạch huyết trong mô mỡ quanh hạch ( 560 ). Khi kiểm tra kỹ hơn, những DC này thực sự được xác định là nằm trong thành mạch bạch huyết giữa các tế bào cơ trơn lân cận. Những DC này đôi khi có chân giả kéo dài vào trong lòng để thu được kháng nguyên và khi được kích hoạt có thể di chuyển đến các hạch bạch huyết. Vì hành vi này đòi hỏi sự tương tác với nội mô nên người ta đưa ra giả thuyết rằng DC trong thành mạch bạch huyết có thể điều chỉnh tính thấm của các mạch này ( 466 ). Khi các tế bào Cd11c + được loại bỏ có chọn lọc bằng độc tố bạch hầu trong 48 giờ, tính thấm của mạch bạch huyết thu thập đã tăng lên khoảng 10 lần. Hơn nữa, khi chuột thiếu Ccr7 , mã hóa một thụ thể cần thiết cho DC dẫn đến mạch bạch huyết, hoặc Irf4 , một yếu tố phiên mã quy định sự biệt hóa của Cd11b + DC, đã được kiểm tra, thu thập tính thấm của mạch bạch huyết cũng tăng tương tự. Kết quả của hai báo cáo này cho thấy rằng DC nằm trong việc thu thập thành mạch bạch huyết để lấy mẫu kháng nguyên và sau khi thu được DC có thể di chuyển tập thể đến các hạch bạch huyết. Điều này sẽ khiến các mạch bạch huyết thu thập tương đối không có DC thường trú, nâng cao đáng kể tính thấm để kháng nguyên di chuyển vào các mô nhanh hơn. Cơ chế như vậy có thể cho phép kháng nguyên có nguồn gốc từ bạch huyết tiếp cận các tế bào T trí nhớ trong mô mỡ để kích thích phản ứng thu hồi tế bào T.
Trong một nghiên cứu khác, việc nuốt vi khuẩn Yersinia psuedotuberculosis qua đường miệng dẫn đến phản ứng miễn dịch cấp tính khỏi hoàn toàn sau 4 tuần, và vi khuẩn bị loại bỏ, nhưng các mạch bạch huyết thu thập trong mạc treo liên tục bị rò rỉ ( 342 ) Các tác giả kết luận rằng các mạch bạch huyết bị rò rỉ có thể dẫn đến suy giảm đáp ứng miễn dịch đối với các bệnh nhiễm trùng gây bệnh tiếp theo ( 342 ). Một phát hiện liên quan là nhiễm trùng tụ cầu vàng kháng methicillin tại chỗ đã được chứng minh là làm tổn thương lớp cơ trơn của hệ bạch huyết thu thập dẫn lưu ở chuột ( 498 ). Trong khi nghiên cứu này tập trung vào sự suy yếu của cơ chế bơm, có thể hình dung rằng tổn thương ở lớp cơ và dẫn đến giảm lưu lượng bạch huyết sẽ tạo điều kiện cho sự rò rỉ bạch huyết qua thành bạch huyết thu thập tăng lên.
Các tế bào miễn dịch được biết đến là có khả năng tạo ra nhiều loại cytokine và các yếu tố khác được biết là có tác dụng điều chỉnh tính thấm của mạch máu. Nhiều cytokine trong số này hiện đang được chứng minh là có tác dụng tương tự đối với nội mô bạch huyết ( 23 , 127 , 213 , 958 ). Các cytokine gây viêm TNF-α, IL-6, IL-1β và IFN-γ đã được chứng minh là làm tăng tính thấm nội mô bạch huyết lên 1,5–3 lần trong nuôi cấy tế bào và tăng khả năng rò rỉ trong cơ thể ( 23 , 213 ). Tương tự như vậy, histamine đã được chứng minh là có tác dụng lên tính thấm của bạch huyết, mặc dù chỉ là tạm thời, trong cả hệ thống nuôi cấy tế bào và ex vivo ( 127 , 958 ). Mặc dù LPS đã được chứng minh là làm tăng tính thấm đơn lớp LEC nhưng nó chỉ kích thích mức tăng gấp 1,5 lần. Vẫn chưa biết liệu phản ứng có cùng cường độ này có thu được trong cơ thể hay không, nhưng đây sẽ là chủ đề của nghiên cứu trong tương lai tập trung vào các cytokine này.
Cơ chế điều hòa tính thấm của bạch huyết
Cơ chế tế bào điều chỉnh tính thấm của các tiểu tĩnh mạch sau mao mạch đã được nghiên cứu rộng rãi và bao gồm truyền tín hiệu qua nhiều thụ thể, protein nối, cAMP/cGMP, Ca 2+ , oxit nitric, MLCK, RhoA/ROCK và các con đường căng thẳng cắt ( 294 , 295 , 1186). ). Cách thức những con đường này ảnh hưởng đến nội mô bạch huyết có thể khá khác nhau do áp suất thủy tĩnh thấp hơn, độ nhạy cao hơn với ứng suất cắt điều chỉnh sự hình thành van trong lòng mạch và thiếu tế bào hồng cầu giải phóng sphingosine-1-phosphate.
Một số chất kết dính bộ nối và các protein liên quan đã được xác định trong các mao mạch bạch huyết và mạch bạch huyết thu thập, bao gồm VE-cadherin, Pecam-1, β-catenin, claudin 5, ZO-1, Occludin, Jam-A và Esam-1 ( 61 ) . Các protein được phân loại là thuộc về các chất kết dính biểu mô cổ điển hơn và các họ liên kết chặt chẽ đều có mặt và hình thành các cấu trúc tương tự như các cấu trúc được thấy trong các kết nối tế bào nội mô mạch máu. Tuy nhiên, người ta biết rất ít về cách mỗi phân tử này góp phần điều hòa tính thấm của bạch huyết. Điều thú vị là, những con chuột bị mất β-catenin đặc hiệu ở bạch huyết có những khiếm khuyết nghiêm trọng trong việc hình thành các van bạch huyết và gây chết phôi, cung cấp một mối liên hệ tiềm tàng khác giữa các khiếm khuyết trong việc hình thành van và điều hòa tính thấm ( 174 ).
Một lời giải thích khả dĩ cho mối liên hệ giữa sự hình thành van và kiểm soát tính thấm là nội mô bạch huyết rất nhạy cảm với ứng suất cắt và ứng suất cắt có thể trực tiếp điều chỉnh tính thấm. Một nghiên cứu đã chứng minh rằng LEC thay đổi tính thấm của chúng khi tiếp xúc với các mức ứng suất cắt khác nhau ( 129 ). Sự thay đổi chức năng rào cản này rất nhạy cảm với các chất ức chế động lực học khung tế bào Actin và với GTPase Rac1 nhỏ. Ngoài ra, hoạt động của Rho kinase (ROCK), tác nhân xuôi dòng của GTPase RhoA nhỏ, dường như rất quan trọng để duy trì tính toàn vẹn của hàng rào đơn lớp LEC cơ bản ( 127 ). Tương tự như vậy, con đường Slit2/Robo4, có thể kích hoạt con đường RhoA/ROCK và cũng ảnh hưởng đến quá trình bản địa hóa integrin α 5 β 1 , gần đây đã được chứng minh là góp phần nâng cao chức năng rào cản đơn lớp LEC ( 1215 ).
Tính thấm của mạch bạch huyết dường như được điều chỉnh một cách khác nhau bởi oxit nitric, tùy thuộc vào tình trạng sức khỏe của nội mạc ( 958 ). Trong điều kiện khỏe mạnh, oxit nitric kích thích tăng tính thấm của mạch bạch huyết thông qua các cơ chế chưa được biết đến. Ở tình trạng bệnh tật khi việc sản xuất oxit nitric bị suy giảm, việc kích thích sản xuất oxit nitric nội sinh dẫn đến độ thẩm thấu thấp hơn, cho thấy rằng mức tín hiệu oxit nitric cơ bản là cần thiết cho chức năng rào cản bình thường. Trong cùng một mô hình, sự ức chế phosphodiesterase-3 làm giảm tính thấm của bạch huyết bằng cách ngăn chặn sự thoái hóa của cAMP. Trong các bối cảnh khác, việc sử dụng trực tiếp các chất tương tự cAMP đã được chứng minh là có tác dụng tăng cường chức năng rào cản của các lớp đơn hoặc ống LEC ( 127 , 870 ).
Phần lớn việc kiểm soát tính thấm của mạch bạch huyết vẫn chưa được biết rõ và vai trò tiềm năng của nó trong cơ chế bệnh sinh của nhiều bệnh là một chủ đề nghiên cứu mới thú vị. Những nỗ lực trong tương lai sẽ hướng vào việc xác định các tín hiệu thần kinh, nội tiết, tế bào và miễn dịch khác nhau tác động như thế nào đến việc thu thập tính thấm của bạch huyết. Ngoài ra, các nghiên cứu trong tương lai về cách các tế bào nội mô bạch huyết tham gia tích cực vào việc kiểm soát việc thu thập chức năng hàng rào bạch huyết là một lĩnh vực đang được nghiên cứu.
Lọc tại các hạch bạch huyết
Trừ một số trường hợp ngoại lệ, bạch huyết được phân phối bằng cách thu thập bạch huyết đến ít nhất một hạch bạch huyết trước khi đi vào ống ngực. Tại đây, các tế bào miễn dịch có thể lấy mẫu bạch huyết để tìm kháng nguyên ( 546 ). Quá trình lọc sinh học này thông qua quá trình thực bào và giữ lại một số tế bào nhất định trong các nút làm cho bạch huyết sau nút khác biệt đáng kể so với bạch huyết trước nút về loại tế bào hiện diện. Trong bạch huyết trước nút, bạch cầu đơn nhân, đại thực bào và tế bào đuôi gai thường hiện diện, nhưng chúng hầu như không có ở bạch huyết sau nút ( 426 ). Ngược lại, số lượng tế bào lympho có thể cao hơn ở bạch huyết sau hạch do thoát ra từ các hạch bạch huyết vào các mạch bạch huyết sau hạch ( 546 ).
Ngoài lọc sinh học, các hạch bạch huyết còn lọc bạch huyết một cách cơ học. Hàng rào máu-bạch huyết trong các nút cho phép chất lỏng không có protein đi qua theo lực Starling. Kết quả là chất lỏng bị mất từ bạch huyết trước nút vào máu, làm tăng nồng độ protein ở bạch huyết sau nút cao hơn ở bạch huyết trước nút ( 8 , 9 ). Do đó, quá trình lọc sinh học và cơ học kết hợp tạo thành bạch huyết sau nút khác biệt về cả chất tan và thành phần tế bào với bạch huyết trước nút.
Các bài viết liên quan
Thomas Bartholin và hệ bạch huyết
Hiệu quả của việc dẫn lưu bạch huyết bằng tay trong điều trị tích cực giai đoạn I của bệnh phù bạch huyết liên quan đến ung thư vú
Cấu trúc và sinh lý mạng lưới mạch bạch huyết – Phần 8: Bạch huyết đường liêu hóa và liệu pháp miễn dịch
Hệ bạch huyết và hạch canh gác: đường dẫn ung thư di căn
Lập bản đồ hệ thống bạch huyết trên các quy mô cơ thể và các lĩnh vực chuyên môn: Báo cáo từ hội thảo của Viện Tim, Phổi và Máu Quốc gia năm 2021 tại Hội nghị chuyên đề về bạch huyết Boston
Hệ thống bạch huyết: Đánh giá về tác động của nắn chỉnh xương
Bệnh tự kỷ, giảm trí nhớ và sương mù não: Thải độc Hệ bạch huyết vùng đầu như thế nào?
Danh mục sản phẩm
-
Hotline mua hàng 096.7786.399
-
Giao hàng miễn phí Đơn hàng >1tr
-
Sản phẩm chính hãng Cam kết chính hãng 100%